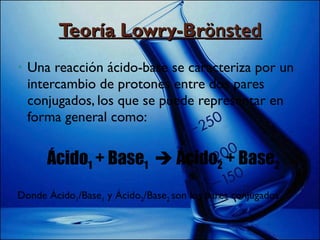
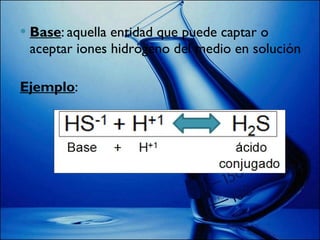
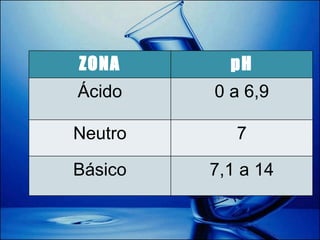
Este documento explica cómo calcular el pH de disoluciones simples. Introduce las teorías de Arrhenius, Brönsted-Lowry y el producto iónico del agua para definir ácidos y bases. Explica que el pH se calcula como el logaritmo negativo de la concentración de iones hidrógeno, y que valores de pH entre 0 y 6,9 son ácidos; 7 es neutro; y entre 7,1 y 14 son básicos. Finalmente, da ejemplos de cálculos de pH y pOH basados en valores numéricos.







![Medida de acidez y basicidad El rango de medición está entre 0 y 14 Se calcula de acuerdo a la concentración de iones hidrógeno [H +1 ] La fórmula para calcular el pH es: pH = -log[H +1 ]](https://image.slidesharecdn.com/ppt2-cido-base-120122202140-phpapp01/85/Ppt-2-acido-base-11-320.jpg)
![Producto iónico del agua (Kw) (1) Kw = [H +1 ]·[OH -1 ] = 1·10 -14 (2) [H +1 ] = [OH -1 ] = 1·10 -14 Relación entre pH y pOH](https://image.slidesharecdn.com/ppt2-cido-base-120122202140-phpapp01/85/Ppt-2-acido-base-13-320.jpg)
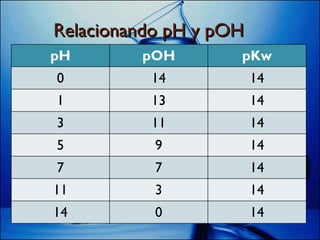
![Kw = [H +1 ] [OH -1 ] /·log logKw = log[H +1 ] + log[OH -1 ] Debemos saber que: logKw = - pKw log[H +1 ] = - pH log [OH -1 ] = - pOH Entonces : pKw = pH + pOH](https://image.slidesharecdn.com/ppt2-cido-base-120122202140-phpapp01/85/Ppt-2-acido-base-14-320.jpg)



![Actividad 3 Determinar el valor de pH, si se conoce el valor de la concentración de iones [H + ] [H + ] = 1x10 -4 M [H + ] = 1x10 -9 M [H + ] = 1x10 -2 M [H + ] = 0,001 M [H + ] = 0,01 M [H + ] = 1x10 -13 M](https://image.slidesharecdn.com/ppt2-cido-base-120122202140-phpapp01/85/Ppt-2-acido-base-19-320.jpg)