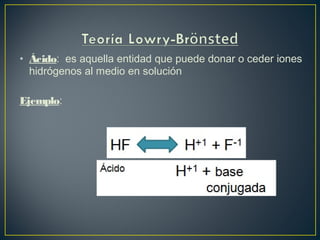
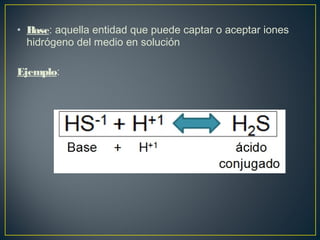
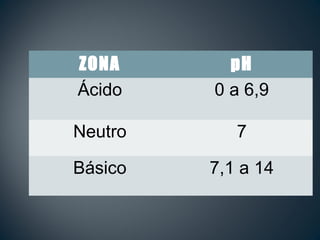
El documento trata sobre los conceptos básicos de ácidos y bases. Explica las teorías de Arrhenius y Lowry-Brönsted sobre ácidos y bases, definiendo un ácido como una sustancia que puede ceder protones y una base como una sustancia que puede aceptar protones. También describe el rango de pH entre 0 y 14 para medir la acidez o basicidad de una solución, así como la relación entre pH, pOH y la constante de ionización del agua.



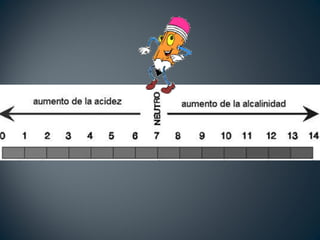




![• El rango de medición está entre 0 y 14
• Se calcula de acuerdo a la concentración de iones
hidrógeno [H+1
]
• La fórmula para calcular el pH es:
pH = -log[H+1
]pH = -log[H+1
]](https://image.slidesharecdn.com/ppt2-cido-base-120122202140-phpapp01-150128071050-conversion-gate01/85/ACIDO-BASE-11-320.jpg)
![Producto iónico del agua (Kw)
(1) Kw = [H+1
]·[OH-1
] = 1·10-14
(2) [H+1
] = [OH-1
] = 1·10-14](https://image.slidesharecdn.com/ppt2-cido-base-120122202140-phpapp01-150128071050-conversion-gate01/85/ACIDO-BASE-13-320.jpg)
![• Kw = [H+1
] [OH-1
] /·log
• logKw = log[H+1
] + log[OH-1
]
Debemos saber que:
• logKw = - pKw
• log[H+1
] = - pH
• log [OH-1
] = - pOH
Entonces:
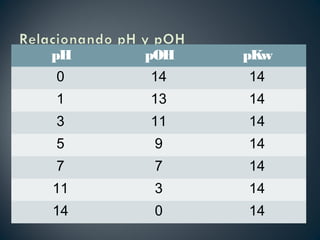
pKw = pH + pOH](https://image.slidesharecdn.com/ppt2-cido-base-120122202140-phpapp01-150128071050-conversion-gate01/85/ACIDO-BASE-14-320.jpg)



![1) Determinar el valor de pH, si se conoce el valor de la
concentración de iones [H+
]
a) [H+
] = 1x10-4
M
b) [H+
] = 1x10-9
M
c) [H+
] = 1x10-2
M
d) [H+
] = 0,001 M
e) [H+
] = 0,01 M
f) [H+
] = 1x10-13
M](https://image.slidesharecdn.com/ppt2-cido-base-120122202140-phpapp01-150128071050-conversion-gate01/85/ACIDO-BASE-19-320.jpg)