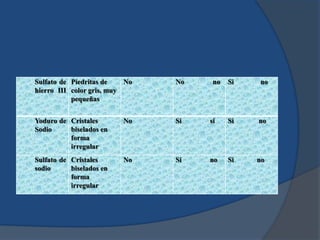
El documento describe un experimento para comparar la capacidad de varias sales de disolverse y conducir electricidad en agua y alcohol. Se midió la solubilidad y conductividad eléctrica de sales como cloruro de sodio, yoduro de potasio y cloruro de cobre en ambos solventes. Los resultados mostraron que las sales son mejores conductoras de electricidad cuando se disuelven en agua en comparación con el alcohol.