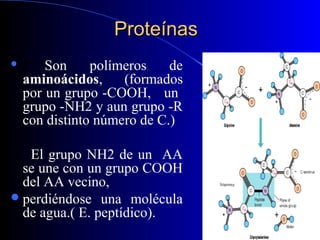
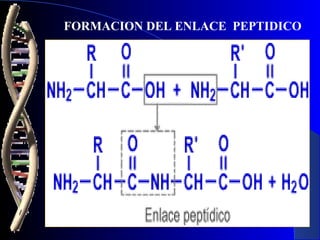
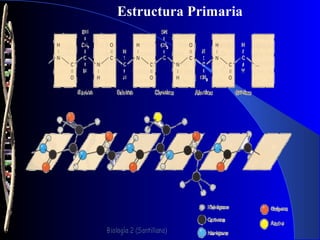
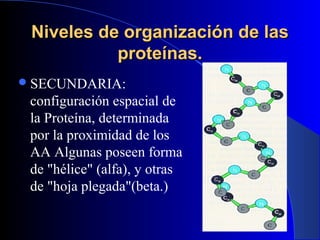
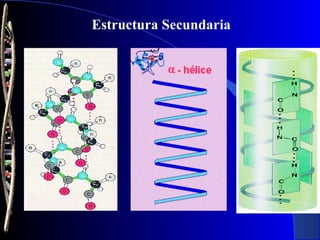
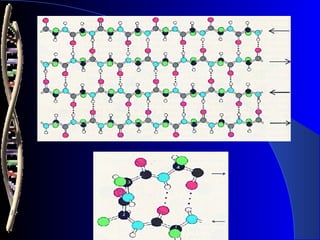
Las proteínas son biomoléculas formadas por carbono, hidrógeno, oxígeno y nitrógeno. Están compuestas por largas cadenas de aminoácidos unidos por enlaces peptídicos. Cumplen funciones estructurales y de regulación metabólica. Se clasifican en esenciales y no esenciales dependiendo de si el cuerpo puede sintetizarlos o no.