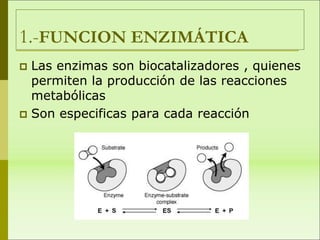
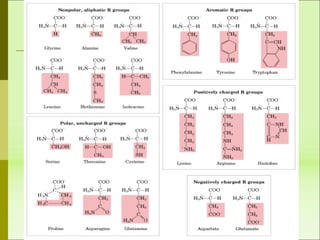
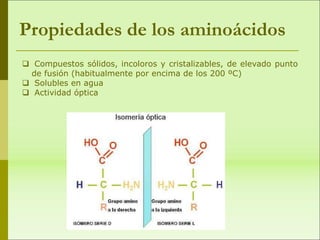
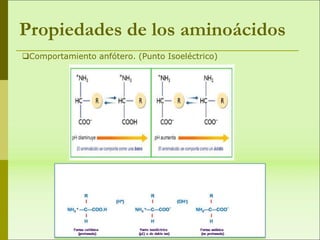
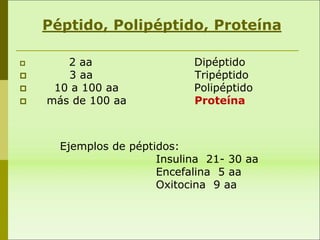
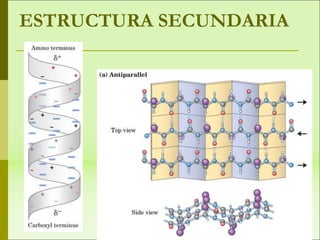
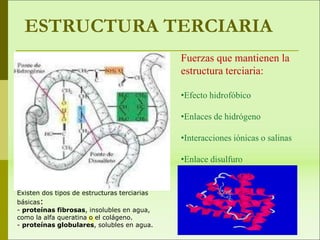
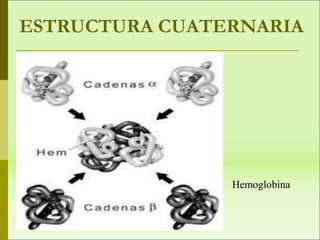
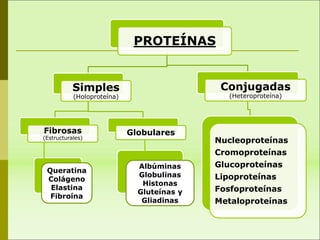
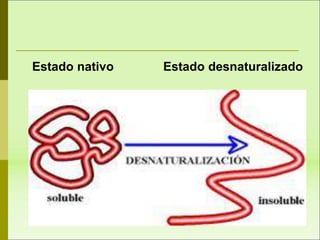
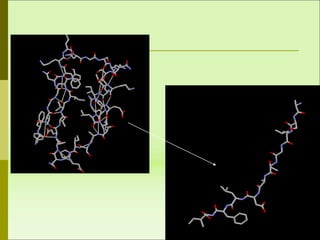
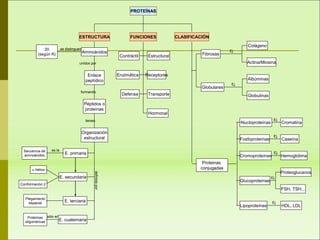
1) Las proteínas son biomoléculas orgánicas formadas por aminoácidos unidos mediante enlaces peptídicos. 2) Cumplen múltiples funciones en los seres vivos como enzimas, hormonas, estructurales, de transporte y defensa. 3) Poseen diferentes niveles de estructura primaria, secundaria, terciaria y cuaternaria que determinan su función.