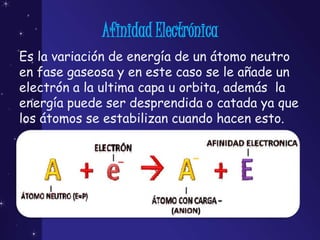
Este documento resume varios conceptos químicos fundamentales como el potencial de ionización, afinidad electrónica, electronegatividad, carácter metálico, volumen y tamaño atómico. El potencial de ionización es la energía necesaria para remover el electrón menos ligado de un átomo neutro. La afinidad electrónica es la variación de energía cuando un electrón es añadido al último nivel de un átomo. La electronegatividad representa la tendencia de un átomo a atraer electrones cuando está enlazado.