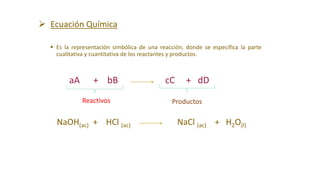
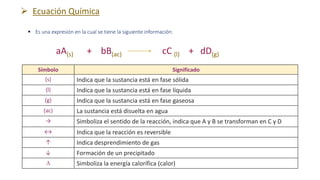
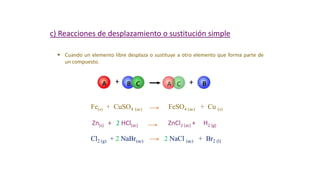
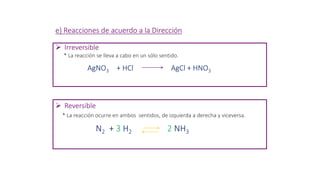
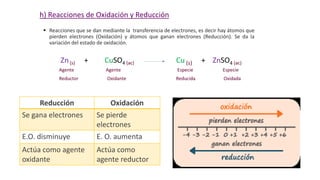
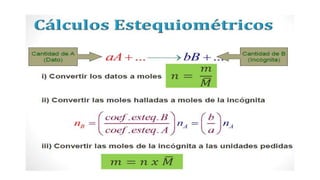
Este documento proporciona una introducción a las reacciones químicas, incluyendo las definiciones de reacción química y ecuación química. Explica los tipos principales de reacciones como combinación, descomposición, desplazamiento y neutralización. También cubre conceptos como exotérmico, endotérmico, combustión completa e incompleta, y oxidación y reducción. El documento ofrece esta información fundamental sobre la estequiometría química.