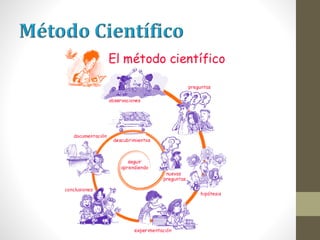
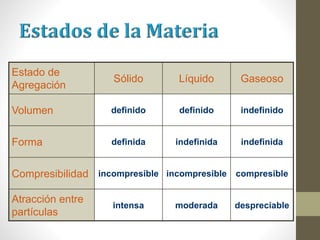
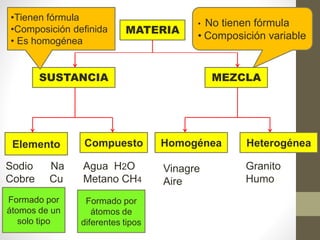
El documento proporciona información sobre la materia y sus propiedades. Explica que la materia puede estar en diferentes estados de agregación (sólido, líquido o gaseoso) y que puede existir como sustancias puras o mezclas. También describe las propiedades físicas y químicas de la materia, así como los diferentes tipos de cambios que puede experimentar.