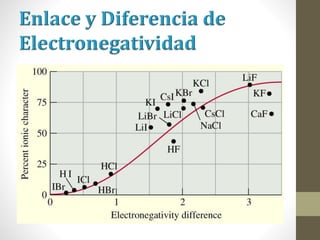
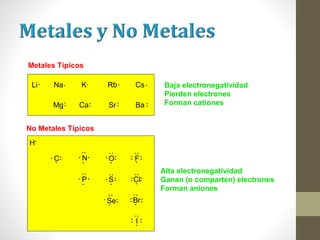
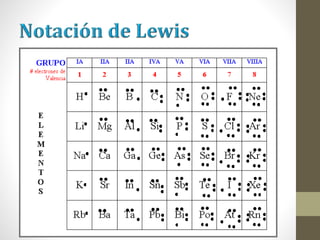
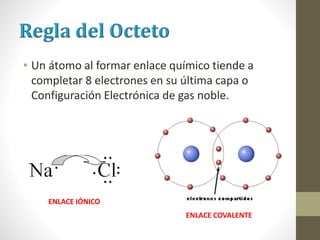
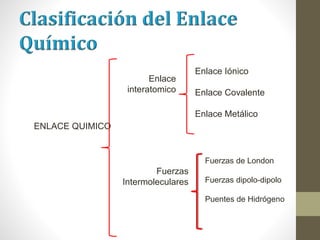
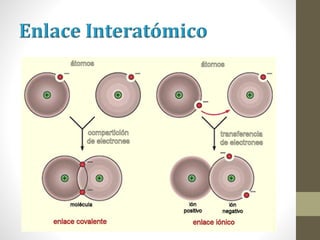
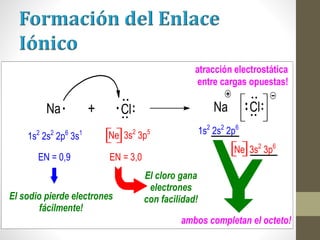
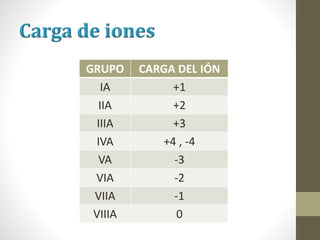
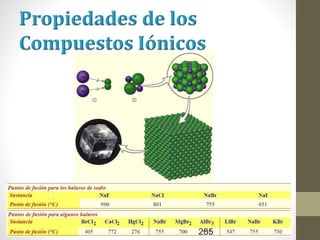
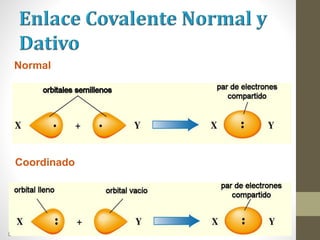
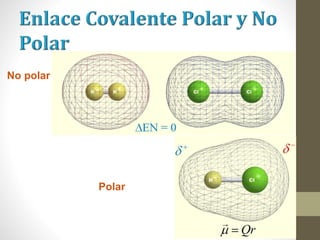
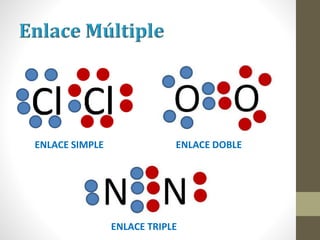
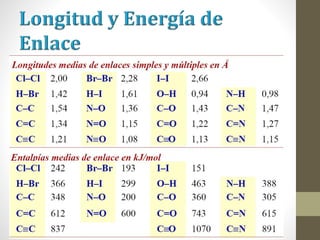
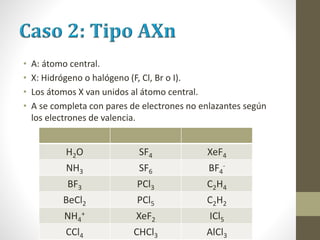
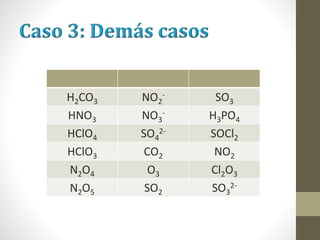
El documento describe los diferentes tipos de enlaces químicos, incluyendo enlace iónico, covalente y metálico. Explica cómo se forman estos enlaces dependiendo de la electronegatividad de los átomos involucrados y cómo esto afecta las propiedades de los compuestos resultantes. También cubre la estructura de Lewis y cómo representar la distribución de electrones en moléculas.