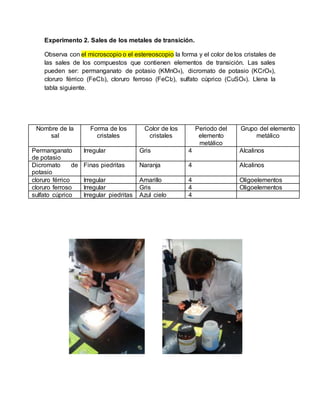
Este documento resume la tabla periódica de los elementos químicos. Explica que los elementos se organizan sistemáticamente en la tabla periódica en función de sus propiedades químicas recurrentes. Detalla la contribución de varios científicos como Dobereiner, Newlands y Mendeleiev en el desarrollo de la tabla periódica a lo largo del siglo XIX. Finalmente, describe la estructura actual de la tabla periódica incluyendo los grupos y períodos principales y cómo se clasifican y organizan los elementos en ella.