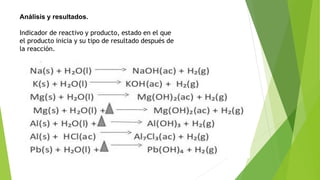
El documento describe un experimento donde se pusieron a reaccionar diferentes metales con agua. Los metales más reactivos fueron el sodio y el potasio, cuya reacción fue casi inmediata y en el caso del potasio incluso produjo una llama. Con el aumento del radio atómico, la reactividad del metal con el agua también aumentó. El experimento confirmó que la reactividad de los metales está relacionada con su tamaño atómico y su posición en la tabla periódica.