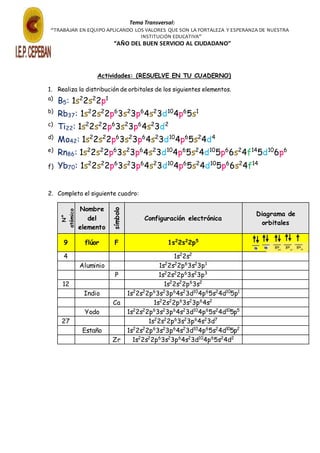
El documento describe la estructura electrónica de los átomos, incluyendo los niveles y subniveles de energía y los orbitales atómicos. Explica que los niveles se representan por letras s, p, d y f y que cada subnivel puede contener un número máximo de electrones. También describe que los orbitales pueden albergar como máximo dos electrones con giros opuestos, y que pueden estar llenos, semillenos o vacíos. Finalmente, incluye ejercicios para practicar la distribución de electrones en diferentes elementos