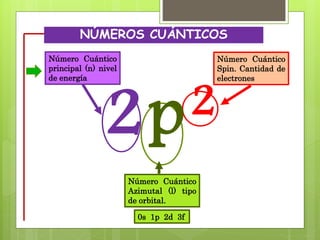
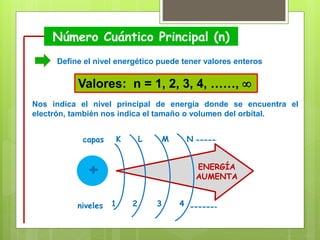
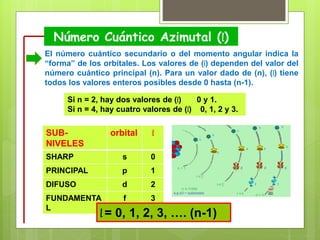
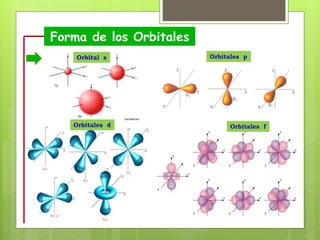
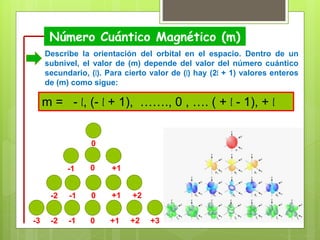
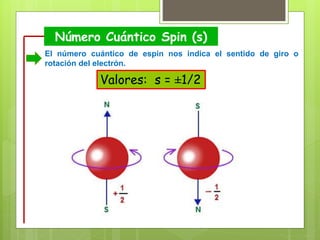
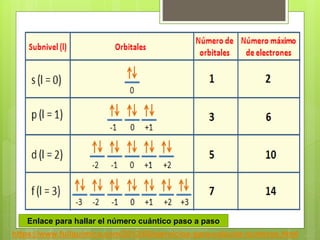
Los números cuánticos determinan la región del espacio-energía donde es más probable encontrar un electrón y consisten en cuatro números: 1) El número cuántico principal (n) define el nivel de energía; 2) El número cuántico azimutal (l) indica la forma del orbital; 3) El número cuántico magnético (m) describe la orientación del orbital en el espacio; 4) El número cuántico de spin (s) indica el sentido de giro del electrón. La teoría cuántica fue desarrollada por físicos como Plan