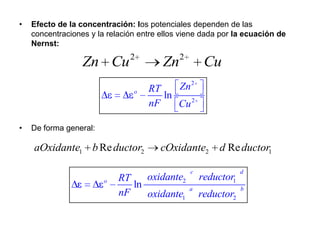
El documento describe las pilas electroquímicas, incluyendo su diseño, funcionamiento y aplicaciones. Específicamente, describe la pila Daniell, que consta de electrodos de cinc y cobre separados por puentes salinos, permitiendo que los electrones fluyan a través de un circuito externo. También explica cómo la energía química se convierte en energía eléctrica y cómo medir la fuerza electromotriz producida.