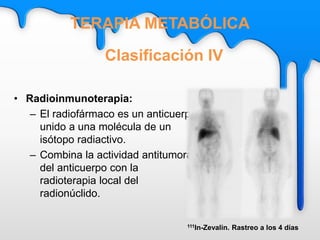
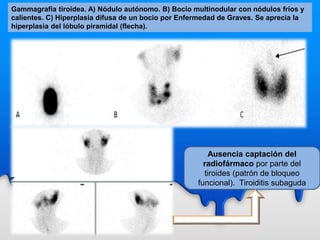
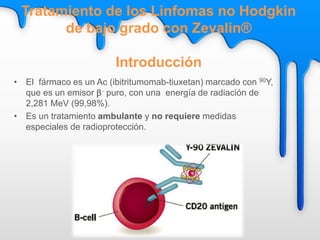
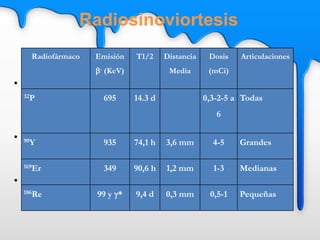
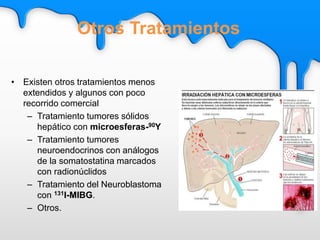
Este documento describe el tratamiento metabólico con radioyodo 131 para la hipertiroidismo y el cáncer diferenciado de tiroides. Explica que el objetivo del tratamiento del hipertiroidismo con 131I es alcanzar una dosis de 50-100 Gy en el tejido tiroideo funcionante, ya sea mediante dosis fijas o individualizadas. También describe los objetivos y procedimiento del tratamiento del cáncer diferenciado de tiroides con 131I, que incluye destruir el tejido tiroideo remanente y posibles focos microsc