Incrustar presentación
Descargar para leer sin conexión

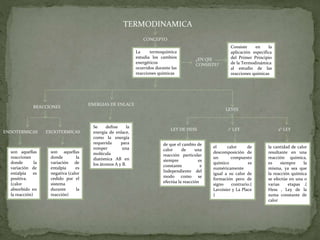
La termoquímica estudia los cambios energéticos durante las reacciones químicas. Consiste en aplicar el Primer Principio de la Termodinámica al estudio de las reacciones. Las reacciones endotérmicas absorben calor durante la reacción, mientras que las exotérmicas ceden calor. Las Leyes de Hess establecen que el cambio de calor de una reacción es constante e independiente del camino, y que el calor de formación de un compuesto es igual pero opuesto a su calor de descomposición

