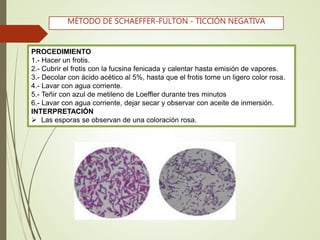
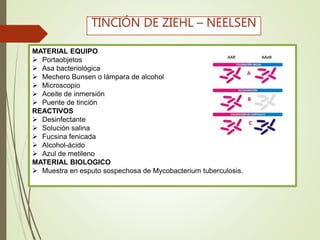
Este documento describe diferentes métodos de tinción para microorganismos. Explica la tinción simple con azul de metileno, la tinción negativa con tinta china para visualizar cápsulas, y la tinción de Gram para diferenciar bacterias Gram positivas de Gram negativas. Además, detalla técnicas para teñir esporas como la de Schaeffer-Fulton y la tinción de Ziehl-Neelsen para bacterias ácido-alcoholesistentes.