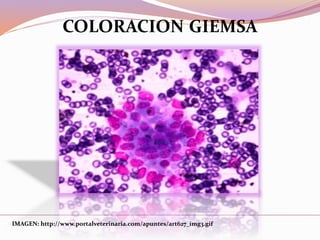
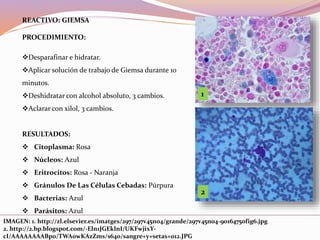
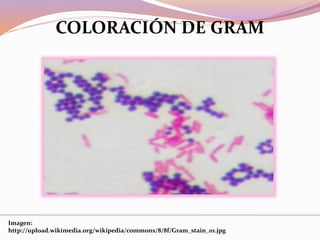
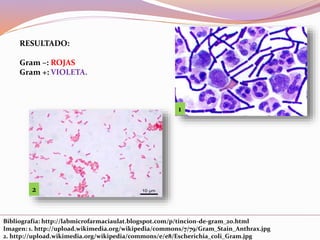
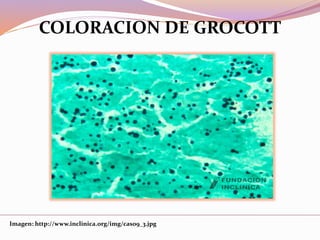
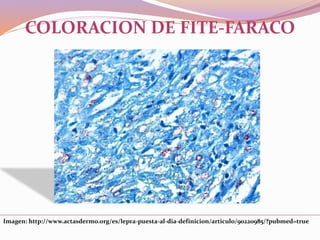
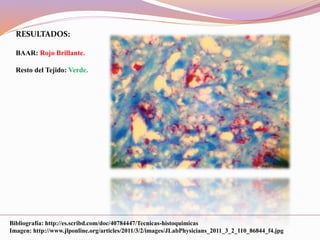
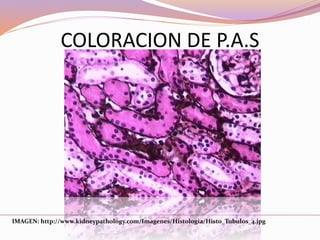
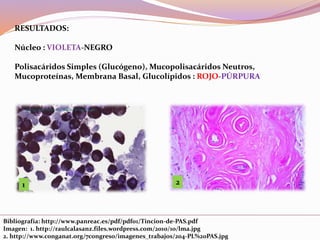
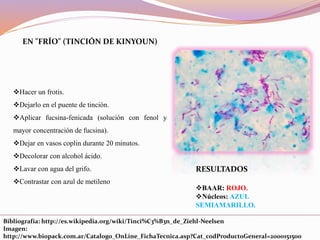
Este documento describe varias técnicas de tinción histológica, incluyendo tinción de Giemsa, Gram, Grocott, Fite-Faraco y PAS. Explica los fundamentos, reactivos, procedimientos y resultados de cada tinción. La tinción de Giemsa se usa para visualizar protozoos y bacterias, Gram diferencia bacterias Gram-positivas de Gram-negativas, Grocott detecta hongos, Fite-Faraco muestra bacilos ácido-alcohol resistentes y PAS revela hidratos de carbono.