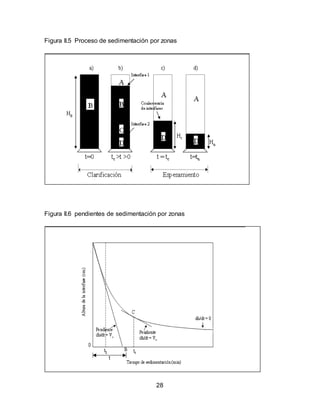
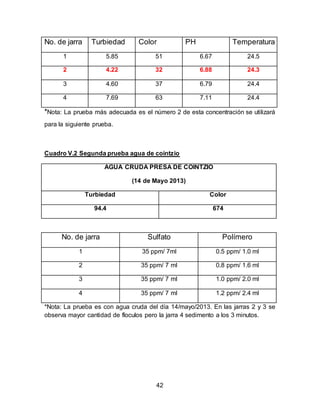
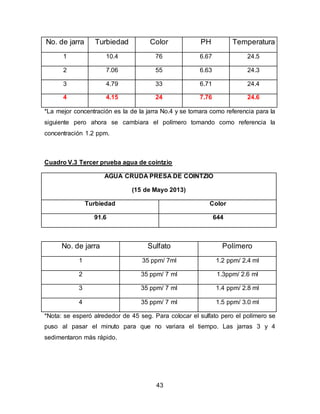
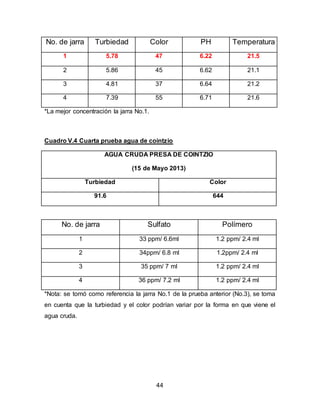
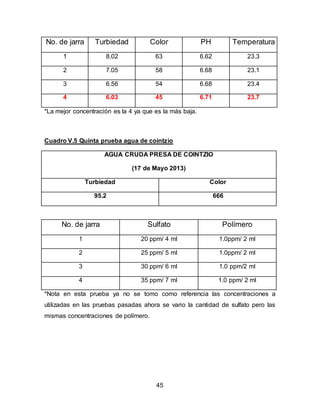
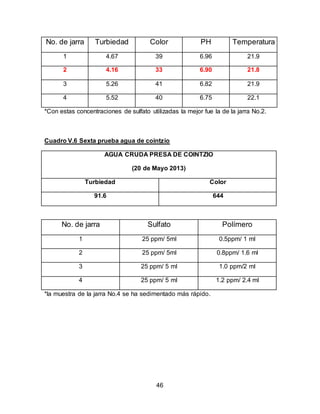
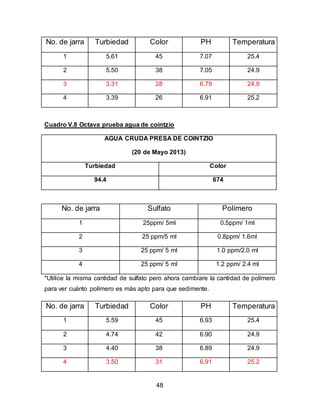
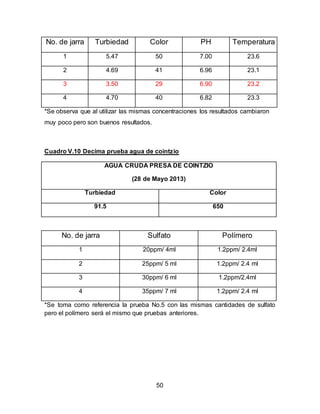
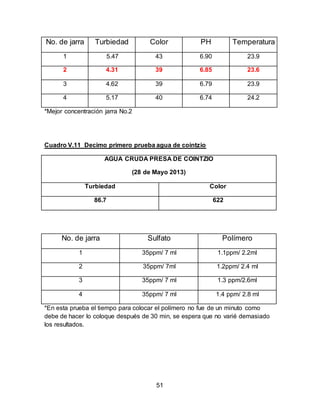
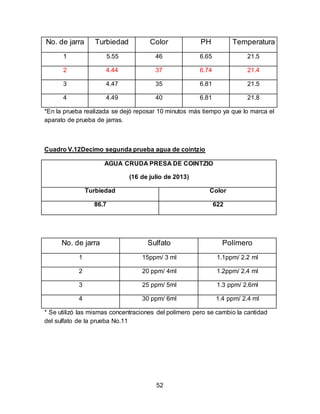
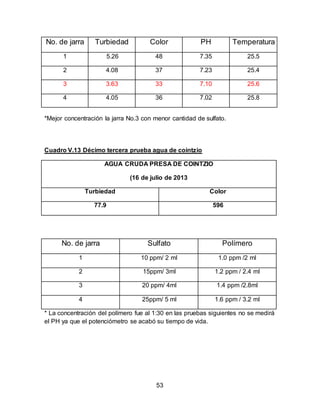
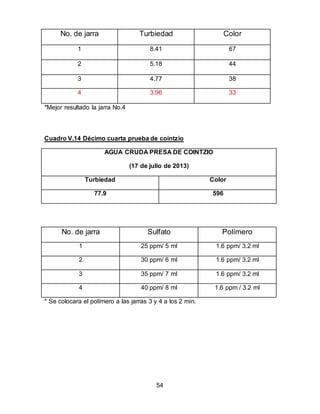
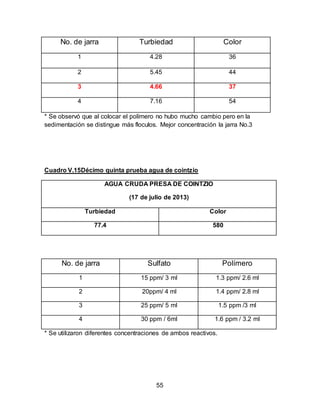
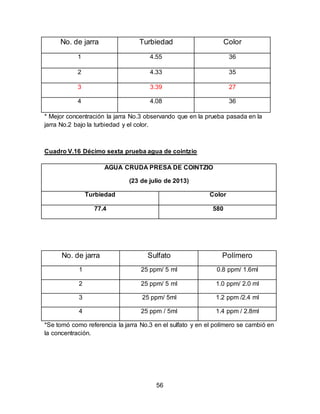
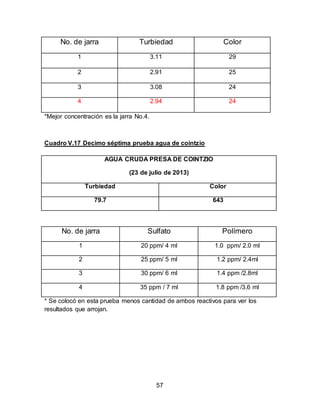
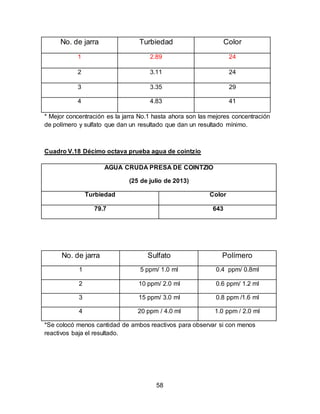
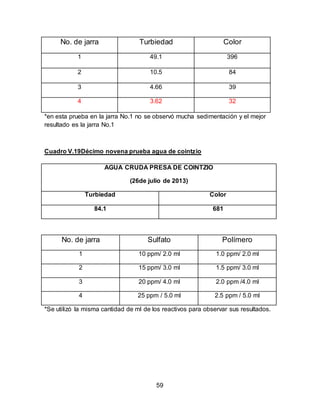
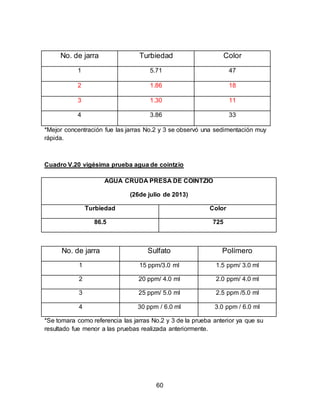
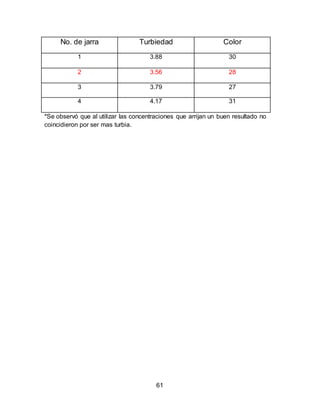
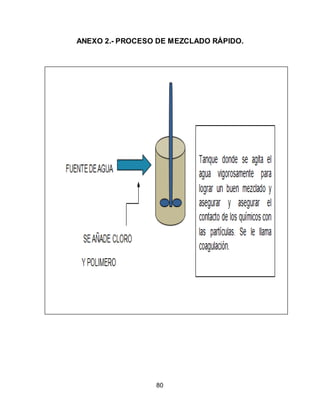
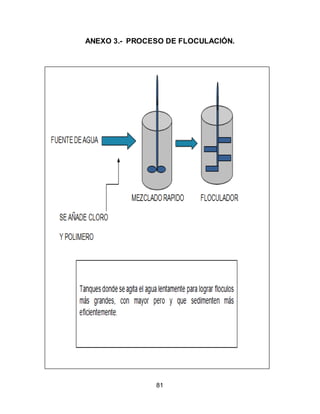
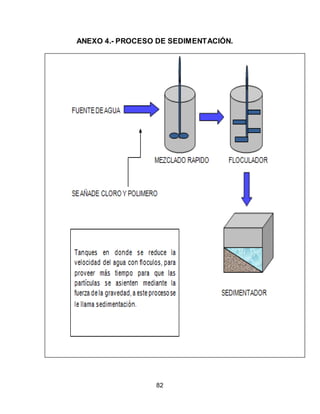
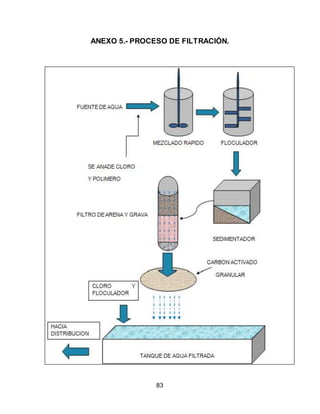
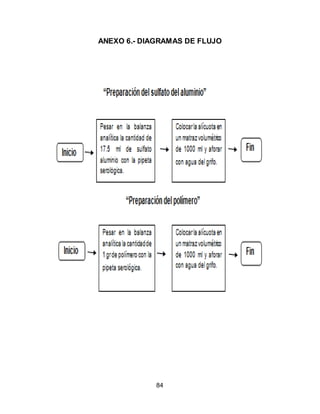
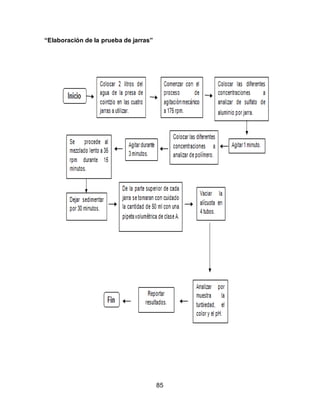
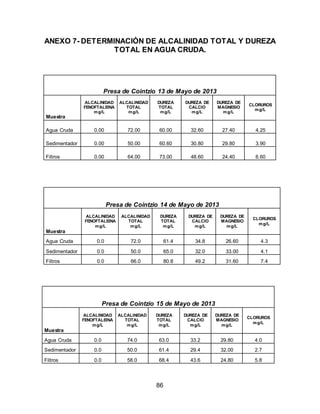
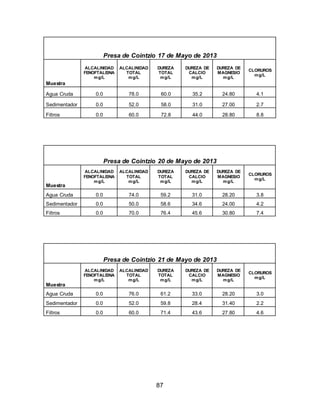
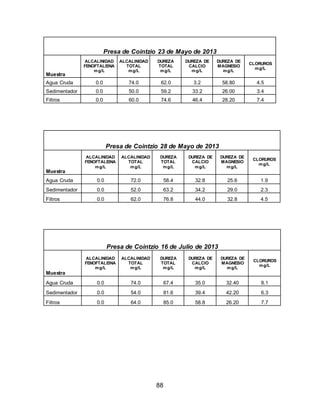
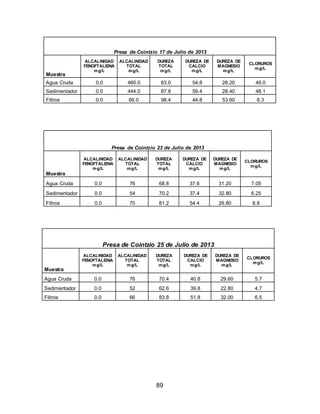
El documento describe el tratamiento convencional del agua de la presa de Cointzio en Morelia, México. Presenta los resultados de 20 pruebas de jarras realizadas para determinar la dosis óptima de coagulante para la remoción de turbiedad. El proceso convencional incluye coagulación, floculación, sedimentación y filtración para potabilizar el agua cruda de la presa y cumplir con los estándares de calidad del agua para consumo humano.