Diagrama de fases
- 1. Diagrama de fases (Punto triple, punto crítico) CRISTHIAN Y. HILASACA ZEA
- 2. Introducción En termodinámica y ciencia de materiales se denomina diagrama de fase o diagrama de estados de la materia, a la representación entre diferentes estados de la materia, en función de variables elegidas para facilitar el estudio del mismo.1 Cuando en una de estas representaciones todas las fases corresponden a estados de agregación diferentes, se suele denominar diagrama de cambio de estado. Los diagramas de equilibrio pueden tener diferentes concentraciones de materiales que forma una aleación a distintas temperaturas. Dichas temperaturas van desde la temperatura por encima de la cual un material está en fase líquida hasta la temperatura ambiente y en que generalmente los materiales están en estado sólido.
- 3. Las sustancias se presentan en estado sólido, líquido o gaseoso; estos se conocen como estados de agregación. Cada uno corresponde a una fase las que graficaremos en adelante y mostraremos sus posibles cambios.
- 4. Toda porción, que puede incluir a la totalidad de un sistema, que es físicamente homogénea dentro de sí misma y limitada por una superficie, de tal modo que sea mecánicamente separable de cualquier otra porción. Definición de Fase Una fase tiene las siguientes características: La misma estructura y ordenamiento atómico en todo el material. Tiene en general la misma composición y propiedades en su interior. Hay una interfase definida entre la fase y cualquiera de las otras fases circundantes.
- 5. Una fase de un material, en términos de su microestructura, es una región que difiere en estructura y/o composición de otra región. agua Agua líquida Hielo Vapor de agua Fase
- 6. DIAGRAMA DE FASES En termodinámica y ciencia de los materiales se denomina diagrama de fase o diagrama de estados de la materia, a la representación entre diferentes estados de la materia, en función de variables elegidas para facilitar el estudio del mismo. Cuando en una de estas representaciones todas las fases corresponden a estados de agregación diferentes se suele denominar diagrama de cambio de estado. Los diagramas de equilibrio pueden tener diferentes concentraciones de materiales que forma una aleación a distintas temperaturas. Dichas temperaturas van desde la temperatura por encima de la cual un material está en fase líquida hasta la temperatura ambiente y en que generalmente los materiales están en estado sólido.
- 7. Un diagrama de fases muestra las fases y sus composiciones en cualquier combinación de temperatura y composición de la aleación. Se tienen 3 tipos de diagramas: • Tipo I: Solubilidad total al estado sólido y liquido • Tipo II: Solubilidad total al estado liquido e insolubilidad al estado sólido • Tipo III: Solubilidad total al estado liquido y solubilidad parcial al estado sólido.
- 9. DIAGRAMA DE FASES GENÉRICO PARA UNA SUSTANCIA PURA
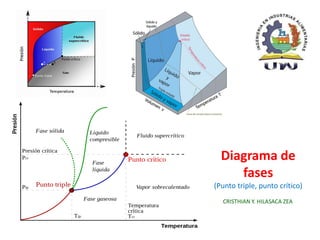
- 10. En el diagrama de fase que se muestra en la figura, las líneas OB, OC y OD corresponden a valores de presión y temperatura en las que coexisten dos fases: En OB, coexisten en equilibrio sólido y gas, se conoce como curva de vapor del sólido; en OC coexisten en equilibrio líquido y gas y en OD coexisten en equilibrio sólido y líquido.
- 11. DIAGRAMA DE FASES OD tiene una pendiente positiva; entonces la fase sólida tiene mayor densidad que la fase líquida O : punto triple T : temperatura en el punto triple Tf: punto de fusión normal Tc: temperatura crítica C : punto crítico P : presión en el punto triple Teb: punto de ebullición normal Pc : presióncrítica
- 12. DIAGRAMA DE FASES OD tiene una pendiente negativa; entonces la fase líquida tiene mayor densidad que la fase sólida O : punto triple T : temperatura en el punto triple Tf: punto de fusión normal Tc: temperatura crítica C : punto crítico P : presión en el punto triple Teb: punto de ebullición normal Pc : presióncrítica
- 13. PUNTO TRIPLE En este punto del diagrama coexisten los estados sólido, líquido y gaseoso. Estos puntos tienen cierto interés, ya que representan un invariante y por lo tanto se pueden utilizar para calibrar termómetros. La sustancia coexiste en equilibrio en los tres estados, está parcialmente solida, parcialmente líquida y parcialmente gaseosa. Además, para valores de presión o temperatura mas bajas que el punto triple la sustancia en cuestión no puede existir en estado líquido y solo puede pasar desde sólido a gaseoso en un proceso conocido como sublimación. En el diagrama de fase que se muestra en la figura, «O» es el punto triple OB : curva de sublimación OD : curva de fusión OC : curva de vaporización (de presión de vapor)
- 14. PUNTO DE EBULLICIÓN En este punto de ebullición de una sustancia, es aquel valor de temperatura para el cual coexisten en equilibrio, los estados líquido y gaseoso a determinada presión. Los diferentes puntos de ebullición para las diferentes presiones corresponderían a la curva OC. PUNTO DE FUSIÓN El punto de fusión de una sustancia, es aquel valor de temperatura para el cual coexisten en equilibrio, los estados líquido y sólido a determinada presión. Los diferentes puntos de fusión para las diferentes presiones corresponderían a la curva OD. PUNTO DE EBULLICIÓN Y PUNTO DE FUSIÓN NORMALES El punto de ebullición normal y el punto de fusión normal se mide a una presión normal de 1 atmósfera (760 mmHg).
- 15. PUNTO CRÍTICO El punto C indica el valor máximo de temperatura en el que pueden coexistir en equilibrio dos fases, y se denomina punto crítico. Representa la temperatura máxima a la cual se puede licuar el gas simplemente aumentando la presión. Gases a temperaturas por encima de la temperatura del punto crítico no pueden ser licuados por mucho que se aumente la presión. En otras palabras, por encima del punto crítico, la sustancia solo puede existir como gas.
- 16. PUNTO CRÍTICO E ISOTERMA CRÍTICA El aumento de presión de un gas a temperatura por debajo de la isoterma crítica, Tc produce un líquido con la aparición de un menisco, un cambio de fase discontinuo. Al aumentar la presión por encima de la isoterma crítica simplemente aumenta la densidad del fluido supercrítico. En el recorrido marcado por las flechas pequeñas, el gas cambia a líquido sin mostrar la discontinuidad del cambio de fase.
- 17. FLUIDO SUPERCRÍTICO Un gas en el punto crítico está a una presión tan elevada y sus moléculas están tan juntas que se vuelve indistinguible de un líquido. Un líquido en el punto crítico se encuentra a una temperatura tan elevada y sus moléculas están tan separadas que no se distingue de un gas. Entonces las dos fases se hacen una y forma un fluido supercrítico, que no es ni un líquido verdadero ni un gas verdadero. Al ir más allá del punto crítico, no ocurre ningún cambio de fase distinto. En vez de ello, aparece momentáneamente un lustre blanquecino aperlado, y la frontera visible entre el líquido y el gas desaparece de forma súbita.
- 18. DIAGRAMA DE FASES DEL AGUA El punto O es el punto triple donde se tienen los únicos valores de presión y temperatura a los que coexisten las tres fases, sólido, líquido y gas en equilibrio. Para el punto triple: T = 0,01°C y P = 0,00603 atm. El punto de fusión normal es 0°C y el punto de ebullición normal es 100°C. Para el punto crítico C, la temperatura crítica es Tc = 374°C y Pc = 218 atm. El agua (hielo) no se puede sublimar a presión normal (1 atm) ya que su punto triple está por debajo de dicho valor (0,00603atm).
- 19. DIAGRAMA DE FASES DEL CO2 El punto O es el punto triple donde se tienen los valores de presión y temperatura únicos a los que coexisten las tres fases, sólido, líquido y gas en equilibrio. Para el punto triple: T = -56,4°C y P = 5,2 atm. El punto de sublimación normal es - 78°C. En el punto crítico C, la temperatura crítica es Tc=31,1°C y Pc=73 atm. El CO2 sólido (hielo seco) si se puede sublimar a presión normal (1 atm) ya que su punto triple está por encima de dicho valor (5,2 atm).
- 20. DIAGRAMA DE FASES PARA EL YODO En este caso las temperaturas del punto de fusión y del punto triple son prácticamente iguales. La curva OC es la curva de presión de vapor del yodo líquido y C es el punto crítico. OB es la curva de sublimación del yodo sólido. La línea casi vertical OD representa el efecto de la presión sobre el punto de fusión del yodo y se denomina curva de fusión. El punto O es el punto triple corresponde a los únicos valores de presión y temperatura a los que coexisten las tres fases, sólido, líquido y gas en equilibrio. Para el punto triple: T = 113,6°C y P = 0,121 atm. El punto de fusión normal es 113,6°C y el punto de ebullición normal es 184,4°C.
- 21. DIAGRAMA DE FASES DEL AGUA
