Factores que afectan la velocidad de una reaccion
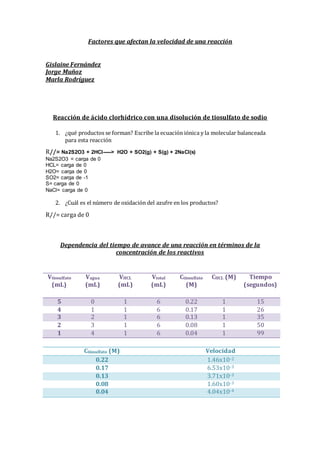
- 1. Factores que afectan la velocidad de una reacción Gislaine Fernández Jorge Muñoz Marla Rodríguez Reacción de ácido clorhídrico con una disolución de tiosulfato de sodio 1. ¿qué productos se forman? Escribe la ecuación iónica y la molecular balanceada para esta reacción R//= Na2S2O3 + 2HCl-----> H2O + SO2(g) + S(g) + 2NaCl(s) Na2S2O3 = carga de 0 HCL= carga de 0 H2O= carga de 0 SO2= carga de -1 S= carga de 0 NaCl= carga de 0 2. ¿Cuál es el número de oxidación del azufre en los productos? R//= carga de 0 Dependencia del tiempo de avance de una reacción en términos de la concentración de los reactivos Ctiosulfato (M) Velocidad 0.22 1.46x10-2 0.17 6.53x10-3 0.13 3.71x10-3 0.08 1.60x10-3 0.04 4.04x10-4 Vtiosulfato (mL) Vagua (mL) VHCL (mL) Vtotal (mL) Ctiosulfato (M) CHCL (M) Tiempo (segundos) 5 0 1 6 0.22 1 15 4 1 1 6 0.17 1 26 3 2 1 6 0.13 1 35 2 3 1 6 0.08 1 50 1 4 1 6 0.04 1 99
- 2. Análisis: Se puede ver en la gráfica que a medida que disminuía la concentración, la velocidad en la que se llevaba a cabo la reacción también disminuía. Dependencia dl tiempo de avance de una reacción en términos de la temperatura de los reactivos. Temperatura Tiempo(s) Velocidad(mol/L . s) °10 123 s 1.06x10-3 °20 95 s 1.36x10-3 °35 45 s 2,8x10-3 °50 36 s 3.6x10-3 °80 5 s 2,6x10-2 0 0.002 0.004 0.006 0.008 0.01 0.012 0.014 0.016 0.22 0.17 0.13 0.08 0.04 Velocidad Ctiosulfato(M) Velocidad Vs. Concentracion C1V1=C2V2 (0.26M)(2ml) = (4ml) C2 (0.26M)(2ml)/ (4ml) = C2 0.13 M =C2
- 3. Temperatura Velocidad °10 V= (0.13M)/123 s V=1.06x10-3 °20 V= (0.13M)/95 s V=1.36x10-3 °35 V= (0.13M)/45 s V=2,8x10-3 °50 V= (0.13M)/36 s V=3.6x10-3 °80 V= (0.13M)/5 s V=2,6x10-2 0 0.005 0.01 0.015 0.02 0.025 0.03 0 1 2 3 4 5 6 v(mol/LxS) t(s) V vs T Series1
- 4. Cuestionario 1. ¿Por qué la soluciónse enturbia a medida que pasa el tiempo? R/ la solución se enturbia debido a que la reacciónentre el tiosulfato de sodio y el ácido clorhídrico,deja comoresultado un precipitado amarillento de azufre,que aumenta su intensidad a medida que pasa el tiempo. 2. ¿Para qué se detiene el cronometro, cada vez,cuando se forma el precipitado? R/ Se detiene el cronometrocada vezque vemos que se forma el precipitado yaque en esta experiencia queremos ver como el factorcambia o afectala reacciónen el tiempo, es decir si causa que la reacción suceda conmayor rapidez o lo contrario que demore más. 3. ¿Por qué se mantiene constante el volumen de la disolución resultante de la mezcla? R./ El volumen de la disolución resultante se mantiene constante ya que si fueran de diferentes volúmenes esto seria otro factor que afectaría la velocidad en la que se lleva acabo la reacción. 4. ¿Por qué se varia solo la concentración inicial de tiosulfato y no también la de acido clorhídrico? R./ Solo varia la concentración del tiosulfato ya que la rapidez de una reacción se expresa con la concentración de uno de los reactivos. 5. ¿porque es necesario seguir temperando la solución cuando ocurre la reacción? R//= Es necesario seguir temperando la solución cuando ocurre la reacción para mantener el mismo efecto de la reacción dada ya que si varia la temperatura con la que se realizó la experiencia puede afectar el resultado obtenido 6. ¿Qué efecto tiene la temperatura sobre la velocidad con que ocurre la reacción para las mismas concentraciones iniciales? R//= La temperatura tiene el efecto de acelerar la velocidad de reacción debido que al aumentar la antes mencionada temperatura las partículas de las sustancias aumentan la velocidad de las mismas chocando unas con otras de modo que las reacciones se llevan de manera más rápida 7. calcular las velocidades obtenidas durante todo el experimento expresándolas en moles / L.S Velocidad de reacción de la 2° parte V= (0.22mol/L)/15 s =1.46x10-2mol/L.s V= (0.17mol/L)/26 s = 6.53x10-3mol/L.s V= (0.13mol/L)/35 s = 3.71x10-3mol/L.s V= (0.08mol/L)/50 s = 1.60x10-3mol/L.s V= (0.04mol/L)/99 s =4.04x10-4mol/L.s
- 5. Velocidad de reacción de la 3° parte V= (0.13mol/L)/123 s =1.06x10-3 mol/L.s V= (0.13mol/L)/95 s =1.36x10-3mol/L.s V= (0.13mol/L)/45 s =2,8x10-3 mol/L.s V= (0.13mol/L)/36 s =3.6x10-3 mol/L.s V= (0.13mol/L)/5 s =2,6x10-2mol/L.s Conclusión En esta experiencia pudimos ver dos de los factores que afectan en la velocidad en la que se da una reacción que son la concentración y la temperatura. Pudimos ver que a una mayor concentración la reacción se daba a acabo a una mayor velocidad y que a medida que bajaba la concentración, también bajaba la velocidad. En el caso de la temperatura, pudimos ver, que a medida que aumentaba la temperatura también aumentaba la velocidad ya que la energía cinética de las moléculas aumenta lo que hace que haya mayor probabilidad de que choquen entre si. -Gislaine Fernández En esta experiencia pudimos observar los factores que afectan la velocidad de una reacción, en este caso usamos 2 de los factores la concentración y la temperatura, En el cual con la concentración pudimos ver que entre mayor concentración mayor será la velocidad en la que se lleva a cabo la reacción, y a menor concentración; más lenta será la reacción. En cambio con la temperatura a mayor temperatura mayor es la velocidad de en la que se lleva la reacción debido a que las partículas se mueven a mayor velocidad. En fin pudimos ver a traves de graficas la dependencia del tiempo en una reacción. -Marla Rodríguez En este laboratorio pudimos observar y poder experimentar sobre los factores que afectan la velocidad de reacción teniendo en cuenta diversos factores, además de los órdenes de reacción que van de 0 a 2 y que sirve para la industria para cuando quieren hacer una reacción, además son fundamentales para el estudio de movimiento de partículas. -Jorge Muñoz
