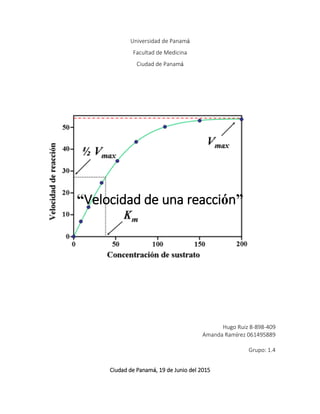
Este documento presenta los resultados de un experimento sobre los factores que afectan la velocidad de una reacción química. El experimento estudió cómo la concentración de los reactivos y la temperatura influyen en el tiempo que tarda la reacción en ocurrir. Los resultados mostraron que a mayor concentración o temperatura, la reacción ocurría más rápido, en menos tiempo. Las conclusiones fueron que la concentración y la temperatura son factores que modifican la velocidad de las reacciones de manera directamente proporcional.