585 fyq 4_eso. atomos y elementos_pres
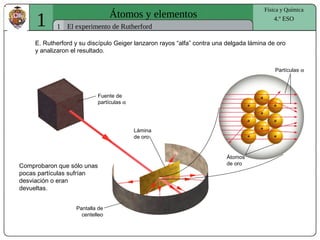
- 1. 1 Átomos y elementos 1 Física y Química 4.º ESO El experimento de Rutherford E. Rutherford y su discípulo Geiger lanzaron rayos “alfa” contra una delgada lámina de oro y analizaron el resultado. Pantalla de centelleo Fuente de partículas α Lámina de oro Comprobaron que sólo unas pocas partículas sufrían desviación o eran devueltas. Átomos de oro Partículas α
- 2. 1 Átomos y elementos 2 Física y Química 4.º ESO Modelo atómico nuclear Rutherford propuso un modelo de átomo que explicaba los resultados de su experiencia, el modelo atómico nuclear. • El átomo está constituido por un núcleo central que concentra la carga positiva y casi toda la masa del átomo. • El átomo está constituido por un núcleo central que concentra la carga positiva y casi toda la masa del átomo. • En la corteza están los electrones, con carga negativa, girando en órbitas concéntricas alrededor del núcleo. • En la corteza están los electrones, con carga negativa, girando en órbitas concéntricas alrededor del núcleo. • El tamaño del núcleo es muy pequeño en comparación con el tamaño de todo el átomo, y además, entre el núcleo y la corteza hay espacio vacío. • El tamaño del núcleo es muy pequeño en comparación con el tamaño de todo el átomo, y además, entre el núcleo y la corteza hay espacio vacío. Electrón Núcleo
- 3. 1 Átomos y elementos 3 Física y Química 4.º ESO El núcleo atómico El núcleo es la parte central del átomo y en él está concentrada la casi totalidad de la masa del mismo. Son partículas con carga eléctrica positiva y con una masa que equivale aproximadamente a la unidad de masa atómica Son partículas con carga eléctrica positiva y con una masa que equivale aproximadamente a la unidad de masa atómica Protón Neutrón PROTONES NEUTRONES Son partículas sin carga eléctrica y con una masa semejante a la del protón. Son partículas sin carga eléctrica y con una masa semejante a la del protón. Las fuerzas nucleares se ejercen entre partículas situadas a muy corta distancia (así están los protones y neutrones del núcleo), y son capaces de estabilizar al núcleo ya que tienen una intensidad mucho mayor que las fuerzas repulsivas de tipo eléctrico entre los protones. Las partículas constituyentes del núcleo son:
- 4. Es la suma del número de protones y el número de neutrones que tiene un átomo. Es el número de protones que tiene un átomo (coincide con el número de electrones si el átomo es neutro) 1 Átomos y elementos 4 Física y Química 4.º ESO Número atómico y número másico Para definir la estructura de un átomo se utilizan dos conceptos: EL NÚMERO ATÓMICO (Z) EL NÚMERO MÁSICO (A) X A Z Estos números se representan a la izquierda del símbolo químico del elemento X. Los átomos del mismo elemento (con igual número atómico) y distinto número másico reciben el nombre de isótopos. H1 1 H2 1 H3 1 Protio Deuterio Tritio ISÓTOPOS DE HIDRÓGENO
- 5. 1 Átomos y elementos 5 Física y Química 4.º ESO El modelo atómico de Bohr En 1913 Niels Bohr propuso un nuevo modelo para el átomo de hidrógeno en forma de postulados. Los electrones giran en órbitas circulares en torno al núcleo debido a la atracción eléctrica protón-electrón. El electrón sólo puede ocupar determinadas órbitas o niveles energéticos. Estos niveles se designan como n = 1, 2, 3… El electrón, moviéndose en su órbita no pierde energía. Si pasa de una órbita externa a otra interna desprende energía. Para la transición contraria la absorbe. Energía Electrón Núcleo Órbitas n =1 n =2
- 6. 1 Átomos y elementos 6 Física y Química 4.º ESO La corteza atómica Actualmente se habla de probabilidades y “nube electrónica” para describir la corteza atómica. Se ha ampliado el número de niveles energéticos considerando subniveles dentro de cada nivel, donde cabe un número determinado de electrones. NIVELDEENERGÍA SUBNIVELES n=1 n=2 n=3 n=4 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f Nº de electrones en cada subnivel 2 6 10 14 Un orbital es aquella región del espacio donde hay más probabilidad de encontrar al electrón. Los cuatro tipos de orbitales se designan con las letras s, p, d, y f.
- 7. 1 Átomos y elementos 7 Física y Química 4.º ESO Forma de algunos orbitales NÚCLEO Orbital SOrbital S Orbital DOrbital D Orbital POrbital P
- 8. 1 Átomos y elementos 8 Física y Química 4.º ESO Configuración electrónica Elemento Configuración electrónica Litio Sodio Potasio Rubidio 1s2 2s1 1s2 2s2 2p6 3s1 1s2 2s2 2p6 3s2 3p6 4s1 1s2 2s2 3s2 3p6 4s2 3d10 4p6 5s1 En los átomos con varios electrones, los electrones llenan los subniveles empezando por los de menor energía y siguiendo un orden creciente de energía, hasta que cada uno de ellos se completa. Observa que el subnivel 3d se llena después del 4s a pesar de pertenecer a un nivel inferior. La expresión de la distribución de los electrones de un átomo en subniveles se denomina configuración electrónica.
- 9. 1 Átomos y elementos 9 Física y Química 4.º ESO El sistema periódico: periodos y grupos Tras sucesivos intentos de clasificación de los elementos químicos, estos han quedado ordenados según sus propiedades y su estructura atómica. En un periodo, cada elemento tiene un protón y un electrón más que el anterior Los elementos de propiedades químicas parecidas se colocan en un grupo o columna. PERIODO ALCALINOTÉRREOS 1 2 3 4 5 6 7 ALCALINOS TÉRREOS CARBONOIDEOS NITROGENEIDEOS ANFÍGENOS HALÓGENOS GASESNOBLES METALES DE TRANSICIÓN EXTERNA LANTÁNIDOS ACTÍNIDOS METALES DE TRANSICIÓN INTERNA
- 10. 1 Átomos y elementos 10 Física y Química 4.º ESO El sistema periódico: metales, semimetales y no metales
- 11. 1 Átomos y elementos 11 Física y Química 4.º ESO El sistema periódico 58 Ce140,12 Cerio Lantánidos 6 71 Lu174,97 Lutecio 70 Yb173,04 Iterbio 69 Tm168,93 Tulio 67 Ho164,93 Holmio 66 Dy 162,50 Disprosio 68 Er167,26 Erbio 65 Tb158,93 Terbio 63 Eu151,96 Europio 62 Sm150,35 Samario 64 Gd157,25 Gadolinio 61 Pm(145) Promecio 59 Pr140,91 Praseodim io 60 Nd144,24 Neodimio 90 Th232,04 Torio 103 Lr(260) Laurencio 102 No(255) Nobelio 101 Md(258) Mendelevi o 99 Es(254) Einstenio 98 Cf(251) Californio 100 Fm(257) Fermio 97 Bk(247) Berquelio 95 Am20,18(243) Americio 94 Pu(244) Plutonio 96 Cm(247) Curio 93 Np237 Neptunio 91 Pa(231) Protoactini o 92 U238,03 Uranio Actínidos 7 17 Cl35,45 Cloro 53 I126,90 Yodo 85 At(210) Astato 9 F18,99 Flúor 35 Br79,90 Bromo 18 Ar39,95 Argón 54 Xe131,30 Xenón 86 Rn(222) Radón 10 Ne20,18 Neón 2 He4,003 Helio 36 Kr83,80 Criptón 14 Si28,09 Silicio 6 C12,01 Carbono 50 Sn118,69 Estaño 82 Pb207,19 Plomo 32 Ge72,59 Germanio 12 Mg24,31 Magnesio 4 Be9,01 Berilio 88 Ra(226) Radio 38 Sr87,62 Estroncio 56 Ba137,33 Bario 20 Ca40,08 Calcio 11 Na22,99 Sodio 3 Li6,94 Litio 87 Fr(223) Francio 37 Rb85,47 Rubidio 55 Cs132,91 Cesio 19 K39,10 Potasio 89 Ac(227) Actinio 39 Y88,91 Itrio 57 La138,91 Lantano 21 Sc44,96 Escandio 109 Mt(266) Meitnerio 108 Hs(265) Hassio 106 Sg(263) Seaborgio 105 Db(262) Dubnio 107 Bh(262) Bohrio 104 Rf(261) Rutherford io 48 Cd112,40 Cadmio 80 Hg 200,59 Mercurio 46 Pd106,4 Paladio 78 Pt195,09 Platino 45 Rh102,91 Rodio 77 Ir192,22 Iridio 47 Ag 107,87 Plata 79 Au196,97 Oro 44 Ru101,07 Rutenio 76 Os190,2 Osmio 42 Mo95,94 Molibdeno 74 W183,85 Wolframio 41 Nb92,91 Niobio 73 Ta180,95 Tántalo 43 Tc(97) Tecnecio 75 Re186,21 Renio 40 Zr91,22 Circonio 72 Hf178,49 Hafnio 30 Zn65,38 Zinc 28 Ni58,70 Niquel 27 Co58,70 Cobalto 29 Cu63,55 Cobre 26 Fe55,85 Hierro 24 Cr54,94 Cromo 23 V50,94 Vanadio 25 Mn54,94 Manganes o 22 Ti20,18 Titanio 15 P30,97 Fósforo 7 N14,01 Nitrógeno 51 Sb121,75 Antimonio 83 Bi208,98 Bismuto 33 As74,92 Arsénico 16 S32,07 Azufre 84 Po(209) Polonio 8 O16,00 Oxígeno 34 Se78,96 Selenio 52 Te127,60 Telurio 13 Al26,98 Aluminio 5 B10,81 Boro 49 In114,82 Indio 81 Tl204,37 Talio 31 Ga69,72 Galio Metales No metales 4 3 2 7 5 6 1 1716 181513 1412109 11865 7421 3 VII AVI A Gases noblesV AIII A IV AII BI BVI BV B VII BIV BII AI A III B VIIIPeriodo Grupo 1 H 1,008 HidrógenoNombre Masa atómica Número atómico Símbolo Negro - sólido Azul - líquido Rojo - gas Violeta - artificial Metales Semimetales No metales Inertes
- 12. 1 Átomos y elementos 12 Física y Química 4.º ESO Estructura electrónica El número que indica el periodo nos informa del número de niveles o capas electrónicas del elemento.
- 13. 1 Átomos y elementos 13 Física y Química 4.º ESO Electrones de valencia Todos los elementos de un mismo grupo tienen el mismo número de electrones en su última capa, son los electrones de valencia. Los electrones de valencia determinan el comportamiento químico del elemento y sus propiedades.
- 14. 1 Átomos y elementos 14 Física y Química 4.º ESO Propiedades periódicas de los elementos: tamaño de los átomos Para comparar el tamaño de los átomos de los elementos químicos, relacionamos entre sí a aquellos que forman parte de un mismo grupo y también a los que están en el mismo periodo. En general, dentro de un grupo el tamaño de los átomos aumenta al descender en el grupo . – + –+ En un mismo período, el mayor volumen corresponde a los elementos alcalinos, y disminuye paulatinamente al avanzar en el período hasta llegar a los halógenos. Los electrones de valencia están en el mismo nivel mientras que el número de protones aumenta y estos electrones serán atraídos por el núcleo con mayor fuerza. El número de capas aumenta y los electrones se encuentran cada vez más alejados del núcleo.
- 15. 1 Átomos y elementos 15 Física y Química 4.º ESO Propiedades periódicas de los elementos: electronegatividad La electronegatividad es la capacidad que tienen los átomos de atraer electrones cuando se unen con otros átomos. En un mismo grupo la electronegatividad aumenta hacia arriba. – + – + Dentro de un mismo período, la electronegatividad aumenta hacia la derecha. El nivel energético es el mismo pero aumenta la carga del núcleo. Disminuyen los niveles energéticos y la atracción por los electrones es mayor.
- 16. 1 Átomos y elementos 16 Física y Química 4.º ESO Propiedades periódicas de los elementos: reactividad La reactividad química es la tendencia que tiene un elemento a reaccionar con otros . En un grupo la reactividad química de los metales aumenta hacia abajo. – + –+ En un período la reactividad de los metales aumenta de derecha a izquierda. La reactividad de los no metales aumenta de abajo a arriba en los grupos y de izquierda a derecha en los períodos. – +–
