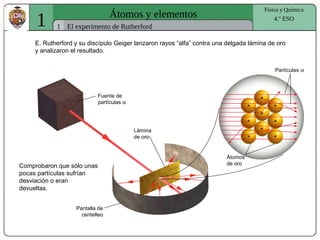
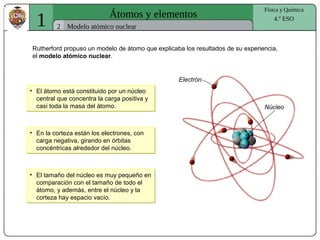
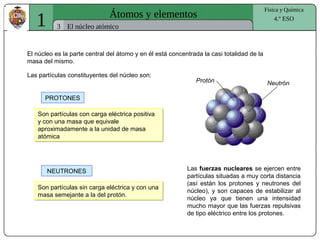
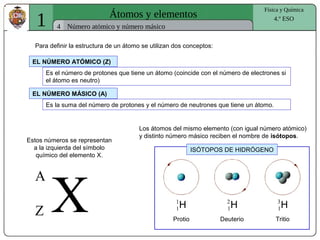
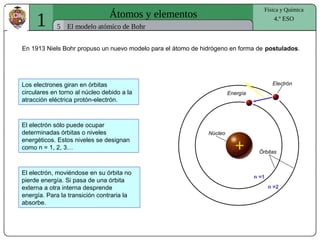
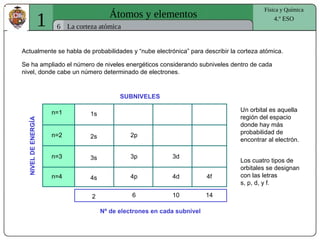
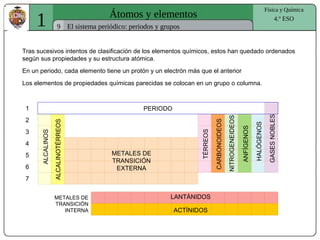
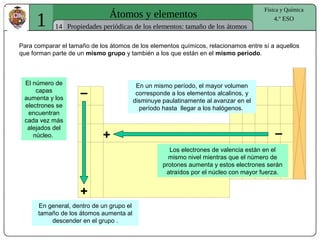
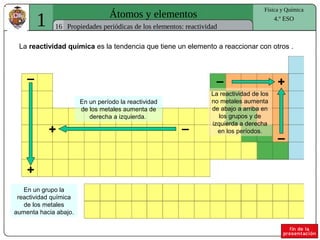
El documento presenta conceptos fundamentales sobre la estructura atómica, explicando el modelo atómico de Rutherford y el modelo de Bohr. Se detallan las partículas subatómicas (protones, neutrones y electrones), las configuraciones electrónicas y el sistema periódico de los elementos. Además, se discuten propiedades periódicas de los elementos, como tamaño atómico, electronegatividad y reactividad.