2.2 enlaces
- 2. Átomos Estables • ¿Por que los átomos forman compuestos enlazándose con otros átomos? • Todo en el universo busca los estados mas estables. Para los átomos la máxima estabilidad es tener sus subniveles s y p completos. • Algunos átomos ganan e- y otros pierden para tener estructuras mas estables
- 3. Electrones de valencia • Son los electrones del mayor nivel de energía • El numero de electrones en el ultimo nivel de energía determina cuantos e puede ganar o perder el átomo.
- 4. Regla del Octeto • La regla del octeto es la tendencia de los átomos a tener una configuración electrónica similar a los gases nobles. • Con excepción de He los gases nobles tienen 8 electrones en su ultimo nivel de energía
- 5. Estructuras de Lewis Solo aplica para elementos representativos
- 6. Simbología punto electrón 6 Los electrones del ultimo nivel son representados con un punto Los electrones de Valencia se acodan alrededor del símbolo del elemento. Mg tiene 2 electrones de Valencia. Pueden tener muchas representaciones Mg Mg Mg Mg Mg
- 7. Lewis estructuras El átomo es representado con su símbolo rodeado por sus electrones de Valencia en forma de puntos Pasos 1. Escribir la configuración electrónica. 2. Identificar los e- de valencia. 3. Dibujar los electrones de valencia alrededor del símbolo. – En cada lado (arriba, abajo, derecha, izquierda) se colocan máximo dos e- – Primero se llena cada lado con un electrón y luego se forman pares
- 8. Ejemplo: Hidrógeno Primero se determina la configuración electrónica del elemento que se desea representar. En el caso del hidrógeno será: 1H = 1S1 Número solo tiene un electrón atómico de valencia. • Se identifica el número de electrones del último nivel.
- 9. Figura de Lewis Los electrones de valencia se dibujan alrededor del símbolo del elemento Símbolo del Unico electrón hidrógeno de valencia H *
- 10. Estructura de Lewis Configuración electrónica: 5B=1s22s22p1 Ultimo nivel de energía Electrones de valencia Primero se coloca Un e- , si hubiera mas De 4 e- entonces se empieza a formar parejas * B
- 11. Estructura de Lewis Configuración electrónica: 8O=1s22s22p4 O* ** * * * Numero de electrones de valencia = 7 Máximo nivel de energía
- 12. Bromo Configuración Electrónica 35 Br =1s22s22p63s23p64s23d104p5 Br Numero de electrones de valencia = 7 Máximo nivel de energía * ** ** **
- 13. Los elementos de una familia los mismos e- de valencia y sus figuras de Lewis son iguales
- 14. Elemento Configuración electrónica e- Valencia Diagrama Lewis Predicción de e- a ganar o perder 11Na 7 N 16 S 17 Cl
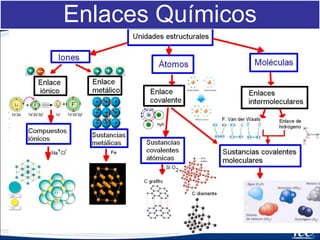
- 15. Tipos de Enlaces
- 16. Introducción • Enlaces químicos –Son la fuerza que mantiene a los átomos juntos en una molécula.
- 17. Introducción Enlaces químicos –En general los electrones se pueden ganar, perder o compartir entre átomos.
- 18. Introducción Tipos de Enlaces – Enlaces Iónicos – Enlaces Covalentes – Enlaces metálicos
- 19. Enlaces • Enlaces Intermoleculares: Enlaces dentro de la molécula: – Iónico – Covalente – Metálico
- 20. Enlaces Iónicos • Trasferencia de electrones (formación de iones) • Metal con un no metal • La diferencia de electronegatividad es mayor 1.7 • En solución conducen la electricidad
- 21. Iónico • Se da entre un metal y no metal • La diferencia de electronegatividad debe ser 1.7 o mayor
- 22. Cuando se forma un enlace iónico, el elemento metálico pierde electrones y en no metal gana teniendo 8 electrones en su ultimo nivel.
- 23. Los no metales ganan electrones: Este proceso es llamado reducción. :Cl. + 1e- :Cl: - 1 Ion Cloruro :O: + 2e- :O: -2 Ion Oxido :N. + 3e- :N: -3 Ion nitruro Formación de aniones
- 24. Los metales pierden electrones formando cationes: Al proceso de perder electrones se le llama oxidación. Na. Na+ + e- Mg: Mg2+ + 2 e- :Al. Al 3+ + 3 e- Formación de cationes
- 25. Cuando los compuestos iónicos están disueltos en agua, se disocian formados una solución con iones: NaCl(s) Na+(aq) + Cl-(aq) Como resultado conducen la corriente eléctrica y son llamados electrolitos. Compuestos Iónicos en solución H2O
- 26. Covalentes • Covalente Polar – Los e- se comparte Simétricamente - Diferencia de electronegativa es menor a 0.4 • Covalente no polar – Los electro e- se comparten de modo asimétrico – La diferencia de electronegatividad es menor a 1.7
- 27. Enlace Metálico • Es la unión de un metal con un no metal • Están unidos por electrones en movimiento (mar de electrones ) • Buenos conductores del calor y electricidad
- 28. Enlace Covalente • Se comparten electrones • Es la unión de un no metal con un no metal • No conducen la corriente eléctrica – Enlaces no polares: Entre átomos cuya diferencia de electronegatividad es menos 0.4 – Enlaces polares : Entre átomos cuya diferencia de electronegatividad esta entre 0.4 y 1.7
- 29. Enlaces polar y no polar H-H es no-polar por que la diferencia de electronegatividad es 0. Cl-Cl is no-polar. H-Cl es polar por que existe una diferencia de electronegatividad pero menor a 1.7 ( H = 2.1, Cl = 3.0 )
- 31. Tipo de enlace Tipo de elementos (metal, no metal) Electronegativi dad de cada elemento Diferencia de electronegatividad Comportamiento electrónico. (Gana, pierde, comparte, se mueve libremente) Conducción de calor y electricidad Iónico Covalente (polar) Covalente (no-polar) Metálico
- 33. Estructuras de Lewis para moléculas 1. Dibuje la figura de Lewis para cada elemento(Use puntos para un elemento y cruces para el otro) 2. Coloque a los átomos en orden lógico. Recuerde que el mas electronegativo es negativo y el otro positivo 3. Distribuya los electrones para cumplir el octeto F O F
- 34. Estructuras de Lewis para Moléculas • Para figuras iónicas el electrón se dibuja en el átomo al que es trasferido • Para un compuesto covalente se puede dibujar como línea F F F ─ F Na O Na
