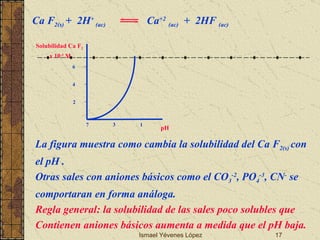
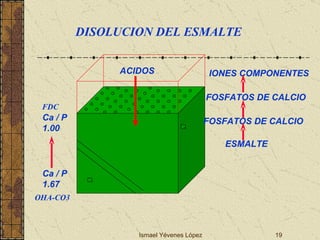
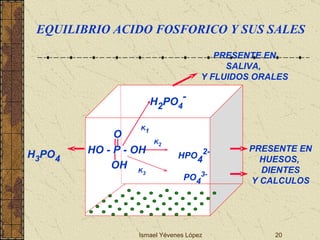
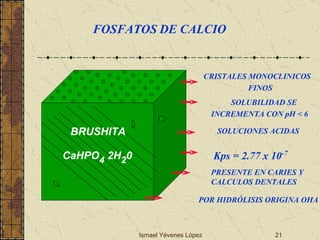
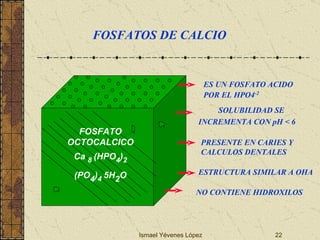
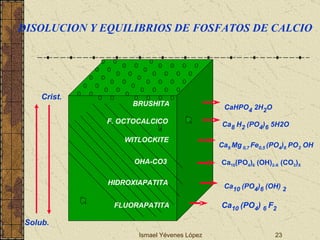
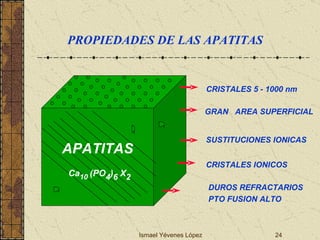
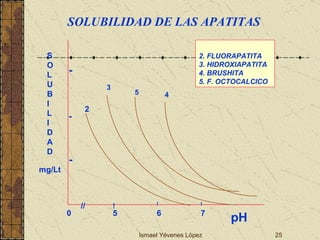
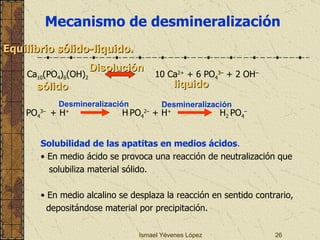
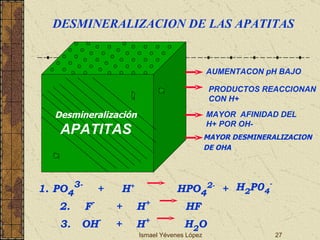
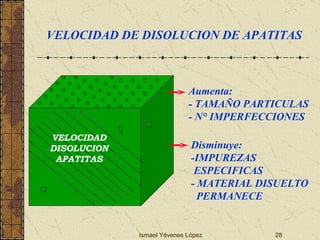
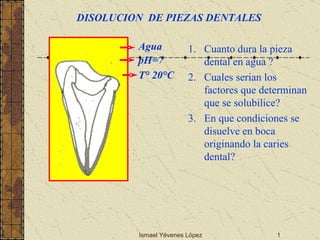
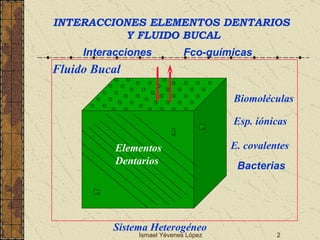
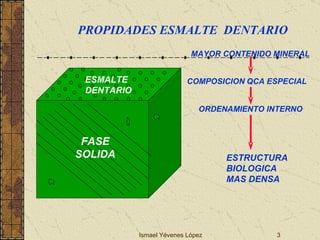
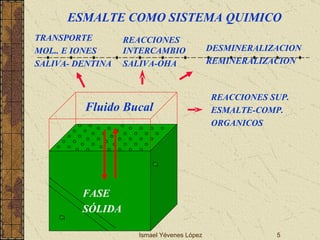
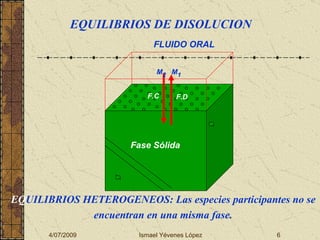
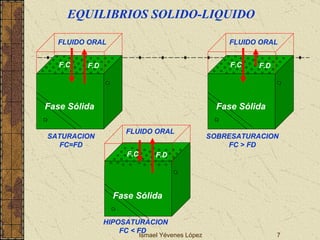
El documento describe los factores que determinan la solubilidad y disolución de las piezas dentales en el fluido bucal, incluyendo la constante de solubilidad, los iones presentes, y cómo el pH afecta el equilibrio. Las piezas dentales contienen hidroxiapatita que se disuelve en condiciones ácidas debido a reacciones iónicas. La solubilidad de las sales dentales depende del pH y la concentración de iones en el fluido bucal.

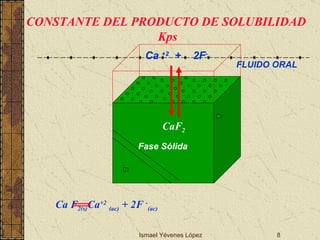
![Ismael Yévenes López [Ca 2+ ] [F - ] 2 K = [CaF 2 ] [CaF 2 ] =cte Kps = [Ca 2+ ] [F - ] 2 = 3.9 x 10 -11 QUE SIGNIFICA ESTE VALOR? SOLUBILIDAD Y Kps Solubilidad: cantidad que se disuelve para formar una solución saturada, se expresa en g/L Solubilidad molar: es el Nº de moles de soluto que se disuelven en un litro de solución saturada, se expresa en mol/L. Solubilidad g/L Solubilidad molar mol/L. Concentración molar de iones Kps](https://image.slidesharecdn.com/02desmineralizacin2009-090810160950-phpapp01/85/02-DesmineralizacioN-2009-9-320.jpg)
![Ismael Yévenes López Ejercicio: Si el Kps de CaF 2 es 3.9 x 10 -11 cual es la solubilidad en g/L Ca F 2(s) Ca +2 (ac) + 2F - (ac) s M 2s M Kps = [Ca 2+ ] [F - ] 2 = s x (2s) 2 = 4s 3 = 3.9 x 10 -11 s = 2.1 x 10 -4 M solubilidad molar Solubilidad: 2.1 x 10 -4 mol CaF 2 x 78.1 g CaF 2 L mol CaF 2 Solubilidad= 1.6 x 10 -2 g/L SOLUBILIDAD Y Kps](https://image.slidesharecdn.com/02desmineralizacin2009-090810160950-phpapp01/85/02-DesmineralizacioN-2009-10-320.jpg)
![Ismael Yévenes López PRODUCTO IONICO DE SOLUBILIDAD Ca 10 (PO 4 ) 6 (OH) 2-X (CO 3 ) X OH - Ca +2 PO 4 -3 CO 3 - Ca 10 (PO 4 ) 6 (OH) 2-X (CO 3 ) X 10Ca +2 + 6PO 4 -3 + (2-x) OH - + x CO 3 -2 DISOLUCION PRECIPITACION SÓLIDO SOLUCION Kps = [Ca 2+ ] 10 . [OH - ] 2-X . [ PO 4 -3 ] 6 . [ CO 3 -2 ] X Fase Sólida FLUIDO ORAL](https://image.slidesharecdn.com/02desmineralizacin2009-090810160950-phpapp01/85/02-DesmineralizacioN-2009-11-320.jpg)
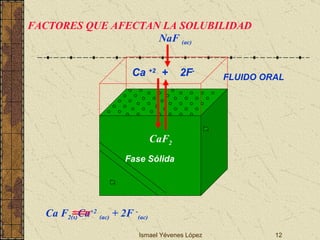
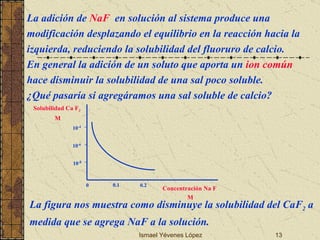
![Ismael Yévenes López ¿Qué pasaría en la cavidad bucal con la solubilidad de las piezas dentales si agregamos o utilizamos fluoruros solubles? Ejercicio 3:Cual es la solubilidad molar del CaF 2 en una disolución que contiene Ca(NO 3 ) 2 0.01 M Kps = [Ca 2+ ] [F - ] 2 = 3.9 x 10 -11 Ca F 2(s) Ca +2 (ac) + 2F - (ac) Inicio 0.01 M 0 Reacción x M 2x M Equilibrio (0.01 + x) M 2x M Kps = [Ca2+] [F-]2 = 3.9 x 10-11 = (0.010+x) (2x)2 3.9 x 10-11 = (0.010) (2x)2 x = 3.1 x 10-5 M Solubilidad en agua:2.1 x 10-4 M, la solubilidad molar del CaF2 d isminuye 10 veces en presencia de una concentración 0.01 M en calcio.](https://image.slidesharecdn.com/02desmineralizacin2009-090810160950-phpapp01/85/02-DesmineralizacioN-2009-14-320.jpg)
![Ismael Yévenes López ¿Cómo se afectara la solubilidad anterior en presencia de 0.01 M en fluoruro? Ca F 2(s) Ca +2 (ac) + 2F - (ac) Inicio 0 0.01 M Reacción x M 2x M Equilibrio x M (0.01+2x) M Kps = [Ca 2+ ] [F - ] 2 = 3.9 x 10 -11 = (x) (0.01+2x) 2 3.9 x 10 -11 = x(0.010) 2 x = 3.9 x 10 -7 M Solubilidad en agua:2.1 x 10-4 M, se observa entonces que la solubilidad molar del fluoruro de calcio disminuye 1000 veces en presencia de una concentración 0.01 M en fluoruro. ¿Por qué es mayor el efecto del fluoruro sobre la solubilidad del fluoruro de calcio?](https://image.slidesharecdn.com/02desmineralizacin2009-090810160950-phpapp01/85/02-DesmineralizacioN-2009-15-320.jpg)