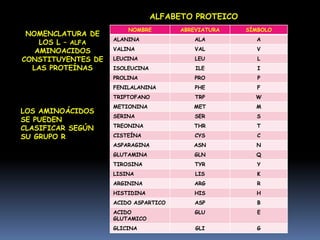
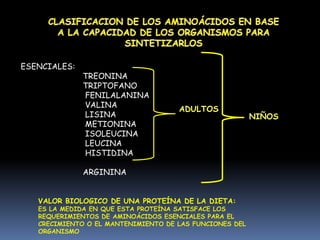
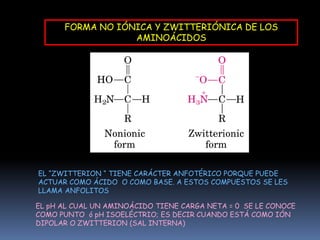
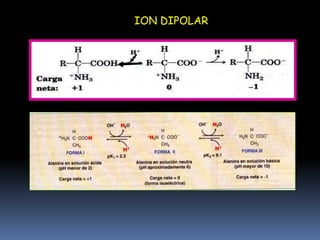
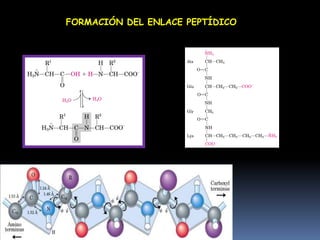
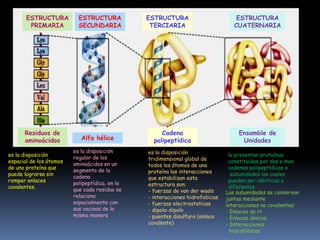
Este documento resume las características fundamentales de las proteínas. Explica que las proteínas son polímeros de aminoácidos que cumplen funciones catalíticas, estructurales y de transporte. Describe la estructura primaria, secundaria, terciaria y cuaternaria de las proteínas, y los factores que estabilizan cada estructura. Además, clasifica los aminoácidos y explica cómo se forman los enlaces peptídicos entre ellos durante la síntesis de proteínas.