Balanceo de ecuaciones REDOX
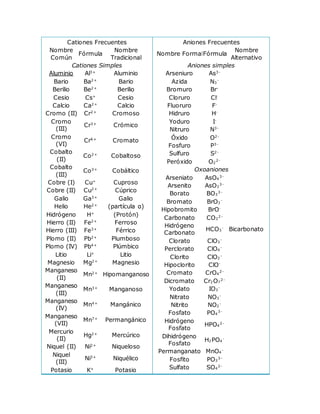
- 1. Cationes Frecuentes Nombre Común Fórmula Nombre Tradicional Cationes Simples Aluminio Al3+ Aluminio Bario Ba2+ Bario Berilio Be2+ Berilio Cesio Cs+ Cesio Calcio Ca2+ Calcio Cromo (II) Cr2+ Cromoso Cromo (III) Cr3+ Crómico Cromo (VI) Cr6+ Cromato Cobalto (II) Co2+ Cobaltoso Cobalto (III) Co3+ Cobáltico Cobre (I) Cu+ Cuproso Cobre (II) Cu2+ Cúprico Galio Ga3+ Galio Helio He2+ (partícula α) Hidrógeno H+ (Protón) Hierro (II) Fe2+ Ferroso Hierro (III) Fe3+ Férrico Plomo (II) Pb2+ Plumboso Plomo (IV) Pb4+ Plúmbico Litio Li+ Litio Magnesio Mg2+ Magnesio Manganeso (II) Mn2+ Hipomanganoso Manganeso (III) Mn3+ Manganoso Manganeso (IV) Mn4+ Mangánico Manganeso (VII) Mn7+ Permangánico Mercurio (II) Hg2+ Mercúrico Niquel (II) Ni2+ Niqueloso Niquel (III) Ni3+ Niquélico Potasio K+ Potasio Aniones Frecuentes Nombre FormalFórmula Nombre Alternativo Aniones simples Arseniuro As3- Azida N3 - Bromuro Br- Cloruro Cl- Fluoruro F- Hidruro H- Yoduro I- Nitruro N3- Óxido O2- Fosfuro P3- Sulfuro S2- Peróxido O2 2- Oxoaniones Arseniato AsO4 3- Arsenito AsO3 3- Borato BO3 3- Bromato BrO3 - Hipobromito BrO- Carbonato CO3 2- Hidrógeno Carbonato HCO3 - Bicarbonato Clorato ClO3 - Perclorato ClO4 - Clorito ClO2 - Hipoclorito ClO- Cromato CrO4 2- Dicromato Cr2O7 2- Yodato IO3 - Nitrato NO3 - Nitrito NO2 - Fosfato PO4 3- Hidrógeno Fosfato HPO4 2- Dihidrógeno Fosfato H2PO4 - Permanganato MnO4 - Fosfito PO3 3- Sulfato SO4 2-
- 2. Plata Ag+ Plata Sodio Na+ Sodio Estroncio Sr2+ Estroncio Estaño (II) Sn2+ Estannoso Estaño (IV) Sn4+ Estánico Zinc Zn2+ Zinc Cationes Poliatómicos Amonio NH4 + Hidronio H3O+ Nitronio NO2 + Mercurio (I) Hg2 2+ Mercurioso Tiosulfato S2O3 2- Hidrógeno Sulfato HSO4 - Bisulfato Sulfito SO3 2- Hidrógeno Sulfito HSO3 - Bisulfito Aniones de Ácidos Orgánicos Acetato C2H3O2 - Formiato HCO2 - Oxalato C2O4 2- Hidrógeno Oxalato HC2O4 - Bioxalato Otros Aniones Hidrógeno Sulfuro HS- Bisulfuro Teleruro Te2- Amiduro NH2 - Cianato OCN- Tiocianato SCN- Cianuro CN- Hidróxido OH- BALANCEO DE ECUACIONES QUIMICAS POR EL METODO DE TANTEO Para el balanceo de ecuaciones por el método de tanteo es importante conocer la Ley de la En una reacción química, la suma de las masa de las sustancias reaccionantes es igual a la suma de las masas de los productos de la reacción. Para igualar ecuaciones por este método han de compararse uno a uno los distintos elementos que figuran en la reacción. Si un elemento cualquiera, X, figura, por ejemplo, en el primer miembro con el subíndice 2 y en el segundo con 1, entonces, en principio, se ha de colocar el coeficiente 2 a la izquierda de la formula de segundo miembro que contiene el elemento X. Tal proceder se sigue sistemáticamente con los restantes elementos lo que obliga a veces a modificar alguno de los coeficientes ya escritos. Igualase, por ejemplo, la reacción: H2 + O2 H2O El hidrogeno ya esta igualado, para ajustar el oxigeno es necesario colocar el coeficiente 2 a la molécula de H2O.
- 3. H2 + O2 2H2O El balance, puesto que el coeficiente 2 afecta tanto al H como al O del agua, se deberá añadir el coeficiente 2 al H2 del primer miembro. 2H2 + O2 2H2O Al establecer la misma cantidad de masa de los reactivos como en los productos se dice que la ecuación esta balanceada. ANEXO BALANCEO DE ECUACIONES QUIMICAS POR EL METODO DE OXIDO- REDUCCION La oxidación se refiere a: La ganancia de oxígeno por parte de una molécula La pérdida de hidrógeno en una molécula La pérdida de electrones que sufre un átomo o grupo de átomos Aumentando en consecuencia su número de oxidación La reducción se refiere a: La pérdida de oxígeno por parte de una molécula La ganancia de hidrógeno en una molécula La ganancia de electrones que sufre un átomo o grupo de átomos Disminución o reducción en su número de oxidación Los procesos de oxidación y reducción suceden simultáneamente y nunca de manera aislada, por lo que se denominan reacciones redox. Para balancear este tipo de reacciones estudiaremos dos métodos: Método redox o cambio del número de oxidación.
- 4. Método de ion electrón. En el método REDOX se realizan los siguientes pasos: Paso 1. Asignar el número de oxidación de todos los elementos presentes en la reacción y reconocer los elementos que se oxidan y reducen. Nota: Todo elemento libre tiene número de oxidación cero. Por ejemplo: Cu0 + H1+N5+ O3 2- → Cu2+(N5+O3 2- )2 + H2 1+ O2- + N2+O2- Paso 2. Escribir las semirreacciones de oxidación y reducción con los electrones de intercambio. Cu0 → Cu2+ + 2e- semirreacción de oxidación N5+ + 3e- → N2+ semirreacción de reducción Paso 3. Balancear el número de átomos en ambos lados de las semirreacciones. En este caso están balanceados: Cu0 → Cu2+ + 2e- N5+ + 3e- → N2+ Paso 4. Igualar el número de electrones ganados y cedidos: 3[Cu0 → Cu2+ + 2e-]
- 5. 2[N5+ + 3e- → N2+] 3Cu0 → 3Cu2+ + 6e-] 2N5+ + 6e- → 2N2+ Nota: El número de electrones ganados debe ser igual al número de electrones cedidos. Paso 4. Colocar los coeficientes encontrados en la ecuación original donde se verificó el cambio del número de oxidación: Cu0 + HNO3 → 3Cu(NO3)2 + H2O + 2NO Paso 5. Completar el balanceo ajustando el número de átomos en ambos lados de la reacción: 3Cu0 + 8HNO3 → 3Cu(NO3)2 + 4H2O + 2NO Balancear por el método redox las siguientes reacciones: a) Fe2O3 + CO → CO2 + Fe b) HNO3 + Sn0 → SnO2 + NO + H2O
- 6. c) Na2S2O3 + H2O2 → Na2SO4 + H2SO4 + H2O d) FeS2 + O2 → Fe2O3 + SO2 e) NH3 + Cu0 → N2 + Cu + H2O Respuesta: a) Fe2O3 + 3CO → 3CO2 + 2Fe b) 2HNO3 + 3SnO → 3SnO2 + 2NO + H2O c) Na2S2O3 + 4 H2O2 → Na2SO4 + H2SO4 + 3H2O d) 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 e) 2NH3 + 3Cu0 → N2 + 3Cu + 3H2O
- 7. I. Reacciones que ocurren en medio ácido. Balancear la reacción química siguiente: CaC2O4 + KMnO4 + H2SO4 → CaSO4 + MnSO4 + K2SO4 + CO2 + H2O Paso 1. Los compuestos iónicos se separan en sus iones componentes, señalando con toda claridad sus cargas correspondientes. Los óxidos y los compuestos covalentes no se separan en iones. Ca2+ + (C204)2- + K1+ + (MnO)1- + H+ + (SO4)2- → Ca2+ + (SO4)2- + Mn2+ + (SO4)2- +K1+ + (SO4)2- + CO2 + H2O Paso 2. Se simplifica la reacción eliminando de ella todas aquellas especies químicas que no tienen cambios durante el proceso. Las especies que permanecen después de esta simplificación son las que toman parte en el proceso redox. El resultado de este proceso recibe el nombre de reacción iónica. En ésta, puede advertirse que aparece el ion H1+, lo que indica que el proceso redox ocurre en medio ácido. (C204)2- + (MnO4)1- + H1+ → Mn2+ + (SO4)2- + CO2 + H2O
- 8. Paso 3. Se escriben las semirreacciones de oxidación y de reducción en cualquier orden: (C204)2- → CO2 semirreacción de oxidación (MnO4)1- → Mn2+ semirreacción de reducción Paso 4. Balance de masa: a. Primero se balancean todos los átomos de los elementos, que no sean oxígeno e hidrógeno. Hay dos átomos de carbono en el primer miembro de la primera semirreacción y sólo uno en el segundo miembro. Esto se ajusta mediante el coeficiente adecuado. (C204)2+ → 2CO2 La segunda semirreacción queda igual. Sólo hay un átomo de manganeso en ambos miembros. (MnO4)1- → Mn2+ b. Ahora se balancea el oxígeno. En medio ácido, el exceso de oxígeno se balancea con agua en el miembro contrario de la semirreacción. En la primera semirreacción el oxígeno está balanceado, no así en la segunda. En ésta hay 4 átomos de oxígeno en el ion (MnO4)1- y por tanto, se balancea con agua como se indicó: (MnO4)1- → Mn2+ + 4H2O Por último se balancea el hidrógeno con iones H+ en el lado contrario:
- 9. 8H++ (MnO4)1- → Mn2+ + 4H2O Con esto concluye el proceso de balance de masa. El resultado es: (C204)2+ → 2CO2 8H++ (MnO4)1- → Mn2+ + 4H2O Paso 5. Balance de carga. Este paso sólo debe realizarse después del balance de masa. Nunca antes.
- 10. Paso 6. Balance del número de electrones perdidos y ganados. El número de electrones perdidos y ganados debe ser el mismo en todo proceso redox. Esto se logra multiplicando por el factor adecuado las semirreacciones redox balanceadas en masa y carga:
- 11. Paso 7. Los coeficientes que se obtienen en la ecuación iónica se trasladan a la reacción general, pero sólo quedarán balanceadas las especies que intervinieron en el proceso redox: Paso 8. Por último se ajustan las especies que permanecieron sin cambios en el proceso redox: II. Reacciones que ocurren en medio básico. Balancear la reacción química siguiente:
- 12. Zn + NaNO3 + NaOH → Na2ZnO2 + NH3 + H2O Paso 1. Los compuestos iónicos se separan en sus iones componentes, señalando con toda claridad sus cargas correspondientes. Los óxidos y los compuestos covalentes no se separan en iones. Los elementos libres tienen carga cero. Zn0 + Na1+ + (NO3)1- + Na1+ + (OH)1- → Na1+ + (ZnO2)2- + NH3 + H2O Paso 2. Se simplifica la reacción eliminando de ella todas aquellas especies químicas que no tienen cambios durante el proceso. Zn0 + Na1+ + (NO3)1- + Na1+ + (OH)1- → Na1+ + (ZnO2)2- + NH3 + H2O Las especies que permanecen son las que toman parte en el proceso redox. El resultado de este proceso recibe el nombre de reacción iónica. En ésta, puede advertirse que aparece el ion (OH)1-, lo que indica que el proceso ocurre en medio básico. Zn0 + (NO3)1- + (OH)1- → (ZnO2)2- + NH3 + H2O Paso 3. Se escriben las semirreacciones de oxidación y de reducción en cualquier orden: Zn0 → (ZnO2)2- (NO3)1- → [NH3]0 Paso 4. Balance de masa:
- 13. Balancear átomos diferentes de oxígeno e hidrógeno. En ambas semirreacciones están balanceados. Balancear los átomos de oxígeno con moléculas de agua. Se cuentan los átomos de oxígeno y se agregan, en igual número, moléculas de agua del otro lado de la reacción o reacciones: 2H2O + Zn0 → (ZnO2)2- (NO3)1- → [NH3]0 + 3H2O Los átomos de hidrógeno por facilidad, se ajustan con iones H+ como si fuera una reacción que se verifica en medio ácido: 2H2O + Zn0 → (ZnO2)2- + 4H+ 9H+ + (NO3)1- → [NH3]0 + 3H2O Para compensar los iones H+, se adicionan igual número de iones (OH)- en ambos lados de las semirreacciones y formar moléculas de agua, los iones (OH)- sobrantes, corresponden al medio básico de la reacción:
- 14. Paso 5. Balance de carga. Este paso sólo debe realizarse después del balance de masa. Nunca antes. Se agregan electrones (e-) para igualar las cargas iónicas: Paso 6. Balance del número de electrones perdidos y ganados. De nuevo, el número de electrones perdios y ganados en el proceso redox debe ser el mismo.Por tanto, las semirreacciones se multiplican por el factor adecuado para lograr este propósito. Al sumar y simplificar las semirreacciones:
- 15. Ecuación iónica completa: Paso 7. Los coeficientes que se obtienen en la ecuación iónica se trasladan a la reacción general, pero sólo quedarán balanceadas las especies que intervinieron en el proceso redox: 4Zn + NaNO3 + 7NaOH → 4Na2ZnO2 + NH3 + 2H2O Paso 8. Por último se ajustan las especies que permanecieron sin cambios en el proceso redox: 4Zn + NaNO3 + 7NaOH → 4Na2ZnO2 + NH3 + 2H2O
- 16. Actividad Investiga cómo se puede identificar al agente oxidante y agente reductor en una reacción de redox. Balancea por el método de ion electrón las siguientes reacciones químicas. Entrégalas a tu asesor de forma escrita para la revisión de los pasos que seguiste, incluye la identificación del agente oxidante y reductor: a) Bi2O3 + KOH + KClO → KBiO3 + KCl + H2O b) Cl2 + KOH → KClO3 + KCl + H2O c) C + HNO3 → CO2 + NO2 + H2O
