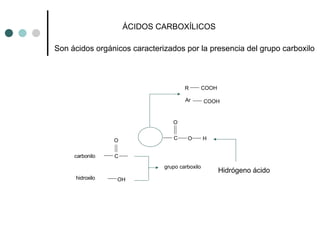
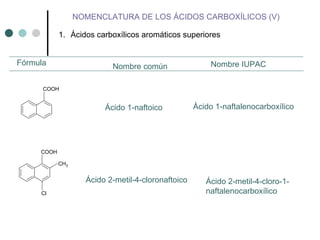
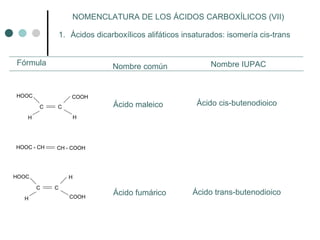
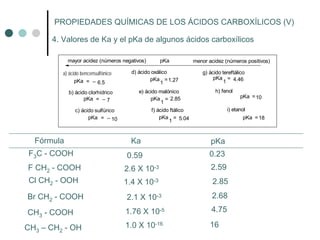
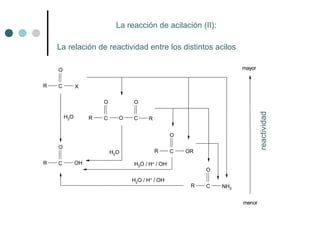
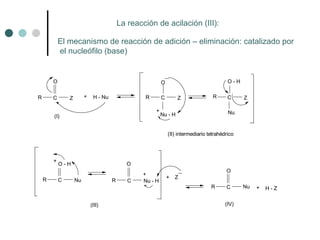
Este documento describe la nomenclatura y propiedades de los ácidos carboxílicos. Los ácidos carboxílicos se caracterizan por el grupo funcional carboxilo y pueden ser alifáticos, aromáticos o dicarboxílicos. Su nomenclatura depende de la estructura química. Los ácidos carboxílicos forman puentes de hidrógeno y su acidez depende de efectos inductivos y resonancia. Pueden obtenerse por oxidación de alcoholes, aldehídos o cadenas laterales