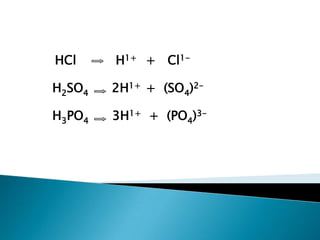
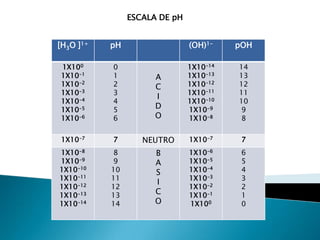
Este documento describe diferentes tipos de soluciones electrolíticas y sus propiedades de conducción eléctrica. Explica que los electrolitos fuertes y débiles ionizan completamente o parcialmente en solución, respectivamente. También define ácidos y bases según las teorías de Arrhenius, Bronsted-Lowry y Lewis, y describe sus propiedades como sustancias iónicas que pueden donar o aceptar protones. Además, introduce conceptos como grado de disociación, pH y escala de pH para medir la acidez