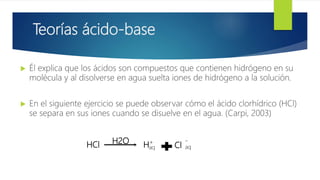
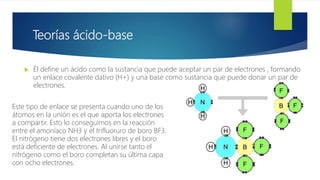
El documento describe las teorías principales sobre ácidos y bases. Robert Boyle nombró por primera vez ácidos y bases en el siglo XVII. Un ácido es cualquier sustancia que aporta iones H+ en disolución acuosa, mientras que una base aporta iones OH-. Las teorías de Arrhenius, Bronsted-Lowry y Lewis definieron ácidos y bases y sus propiedades químicas. Arrhenius definió ácidos como sustancias que liberan H+ en agua y bases como sustancias que liberan OH-. Bronsted-Low