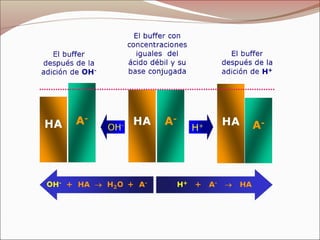
Los buffers o soluciones amortiguadoras son capaces de resistir cambios en el pH al añadir ácidos o bases, conteniendo un par conjugado ácido-base débil. Mantienen condiciones adecuadas para las reacciones bioquímicas en sistemas vivos, como la sangre, cuyo pH normal oscila entre 7.35 y 7.45. El sistema H2CO3-HCO3- es el principal amortiguador en la sangre, mostrando mayor capacidad para neutralizar el exceso de ácido.