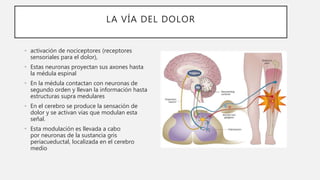
El documento describe la vía del dolor y los mecanismos de inhibición y modulación del dolor. Explica que el dolor se transmite a través de las neuronas del sistema nervioso hasta el cerebro, donde se produce la sensación de dolor. El cerebro regula esta señal a través de vías que modulan la percepción del dolor. Algunos opioides endógenos y fármacos opiáceos actúan sobre estos mecanismos de modulación para producir analgesia.