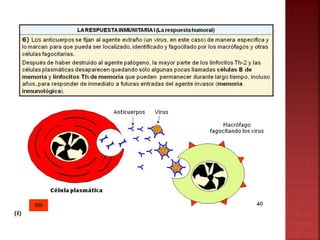
El documento describe las características y funciones de los anticuerpos. Los anticuerpos son proteínas producidas por los linfocitos B que reconocen y unen antígenos extraños. Tienen diversidad y especificidad. Cumplen funciones como la neutralización de patógenos, activación del sistema complemento y opsonización para fagocitosis.