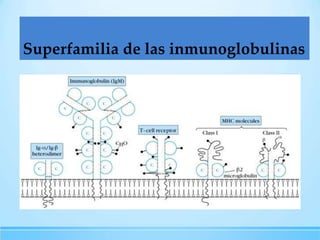
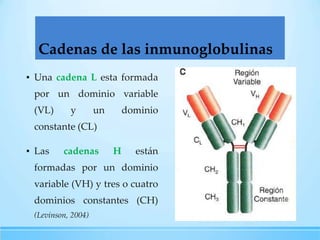
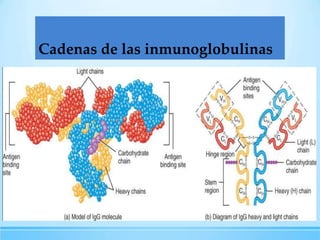
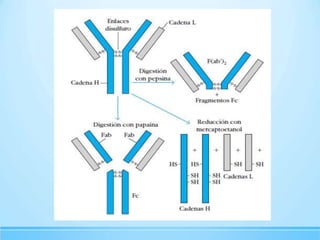
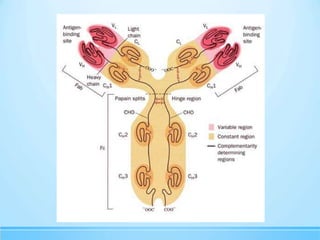
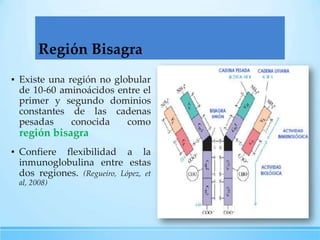
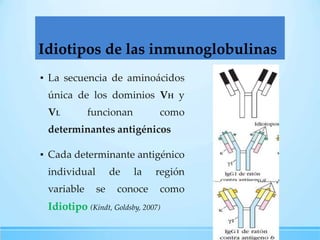
Las inmunoglobulinas son moléculas producidas por los linfocitos B que funcionan como anticuerpos para unirse a antígenos específicos. Están compuestas de cadenas pesadas y ligeras unidas por puentes disulfuro. Existen 5 clases principales (IgG, IgM, IgA, IgE, IgD) que se diferencian en su estructura y funciones como la opsonización, activación del complemento y citotoxicidad mediada por células.