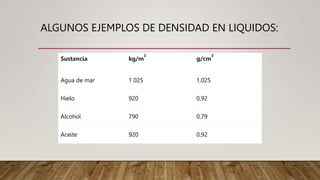
La materia puede definirse como todo lo que ocupa un espacio y tiene masa, forma, peso y volumen. Se clasifica en sustancias puras como elementos y compuestos, y mezclas como homogéneas y heterogéneas. Las mezclas pueden separarse mediante métodos físicos como filtración, evaporación, decantación, entre otros. Las sustancias tienen propiedades físicas como densidad, punto de fusión, y propiedades químicas como reactividad.