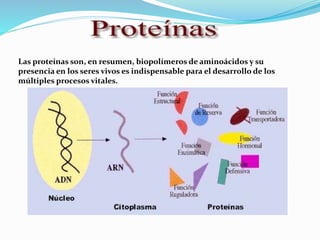
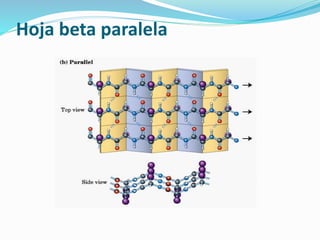
El documento describe las cuatro estructuras principales de las proteínas: la estructura primaria es la secuencia lineal de aminoácidos, la estructura secundaria incluye hélices alfa y hojas beta formadas por puentes de hidrógeno, la estructura terciaria es la forma tridimensional completa, y la estructura cuaternaria se refiere al arreglo de múltiples cadenas en proteínas complejas. La estructura de una proteína determina su función biológica.