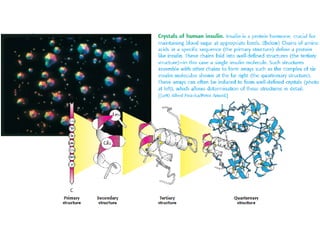
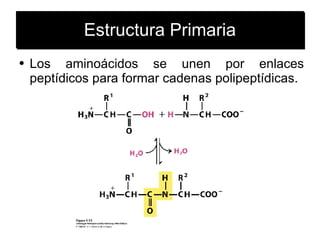
Este documento describe las diferentes estructuras de las proteínas, incluyendo la estructura primaria (cadena de aminoácidos), secundaria (patrones de hélice alfa y hojas beta), terciaria (plegamiento de la cadena en una forma tridimensional) y cuaternaria (proteínas compuestas de múltiples cadenas o subunidades). También describe elementos estructurales como motivos, dominios, asas y giros que permiten el plegamiento de la cadena en su forma nativa tridimensional.