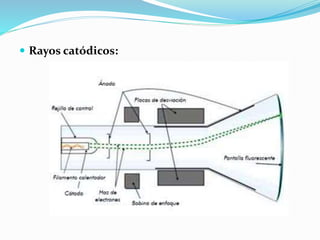
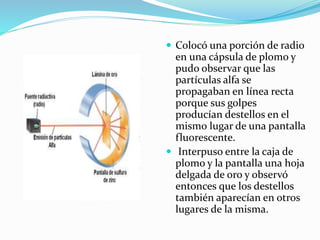
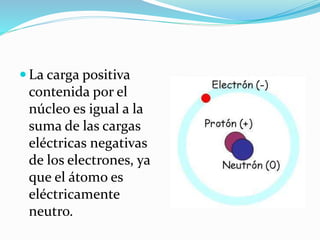
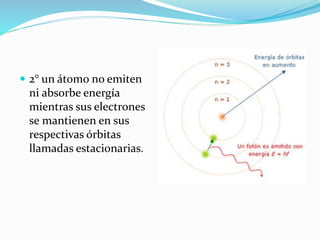
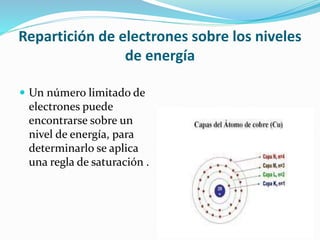
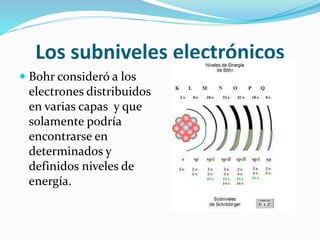
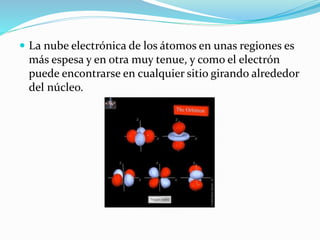
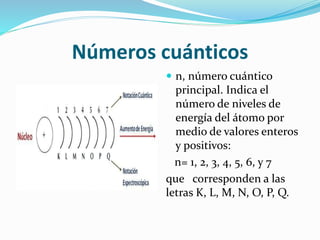
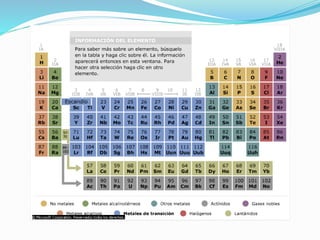
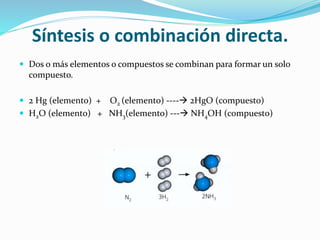
El documento resume la historia y desarrollo de la estructura atómica desde las primeras teorías griegas hasta los modelos atómicos modernos. Explica que los átomos están compuestos de un núcleo central con protones y neutrones rodeados por electrones, y que los electrones se distribuyen en niveles y subniveles de energía de acuerdo a sus números cuánticos. También describe los diferentes tipos de enlaces químicos y reacciones.