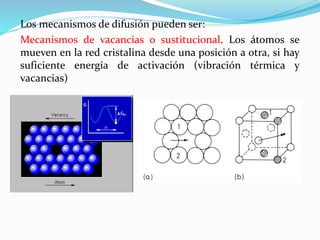
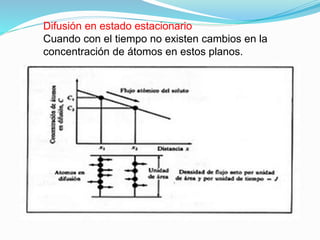
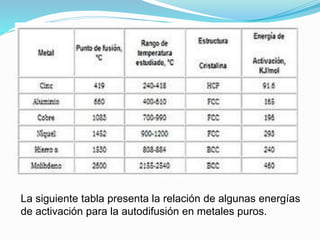
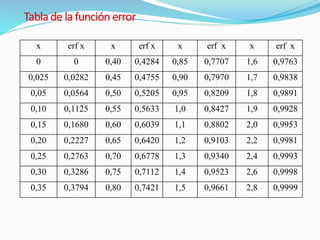
La difusión es el mecanismo por el cual los átomos se mueven a través de un material sólido, líquido o gaseoso. En los sólidos, la difusión permite las reacciones en estado sólido y el crecimiento de granos. Existen dos mecanismos de difusión: difusión por vacantes o sustitucional, donde los átomos se mueven a posiciones vacantes; y difusión intersticial, donde los átomos se mueven a través de los espacios intersticiales. La energía de activación