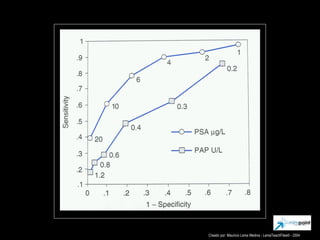
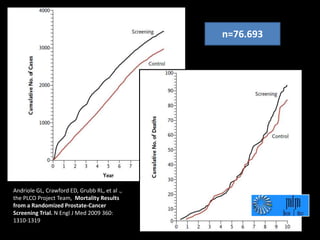
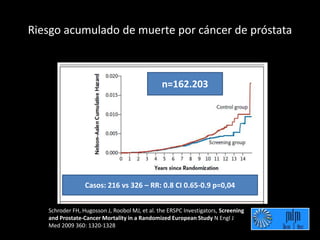
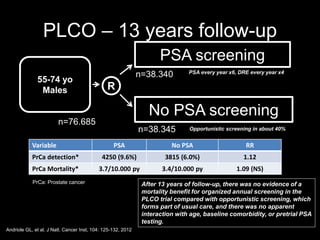
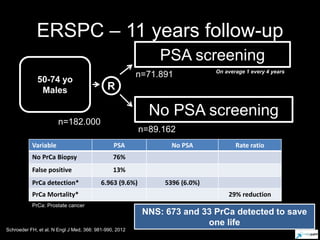
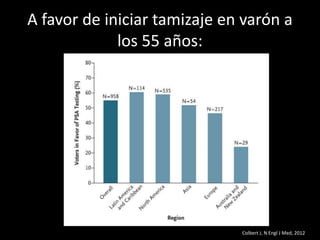
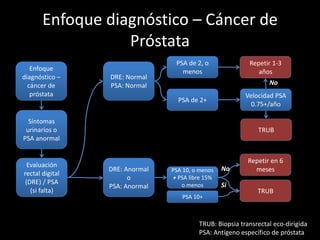
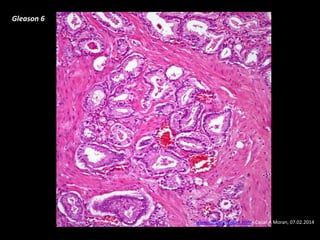
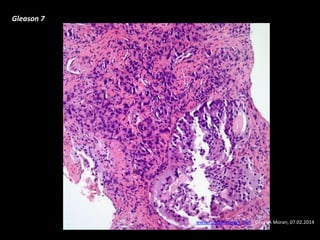
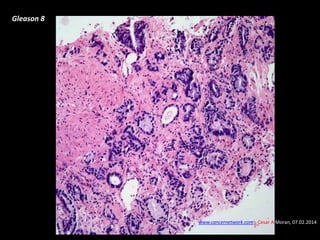
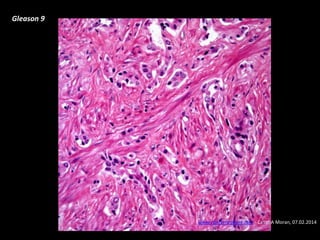
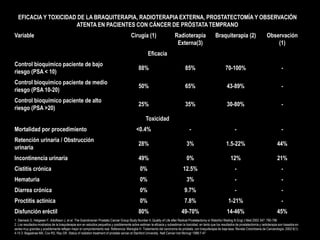
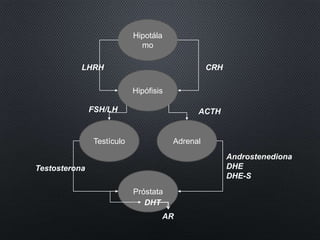
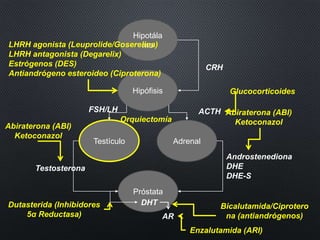
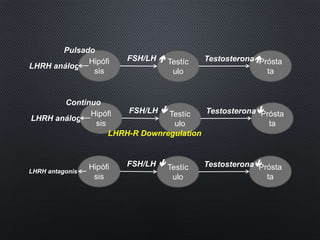
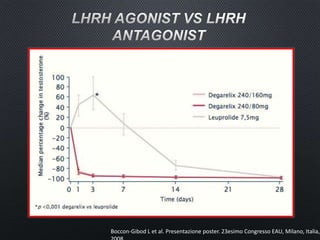
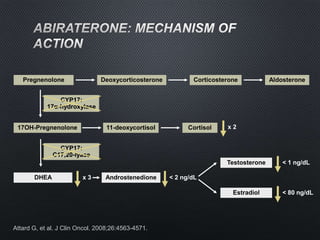
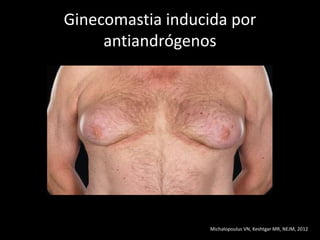
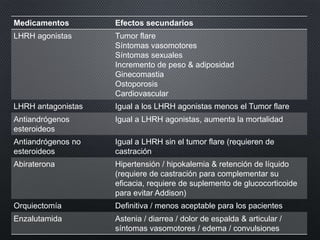
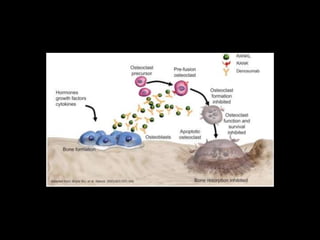
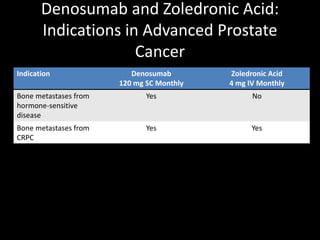
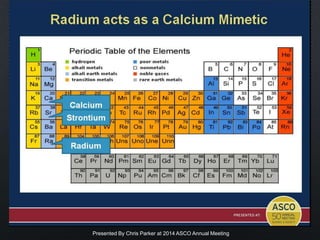
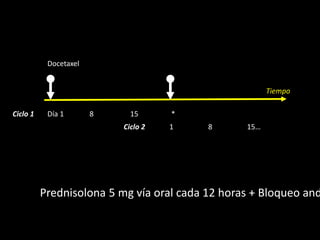
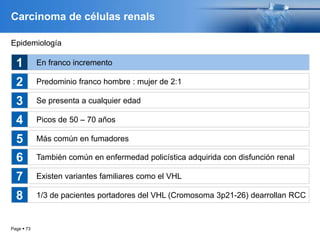
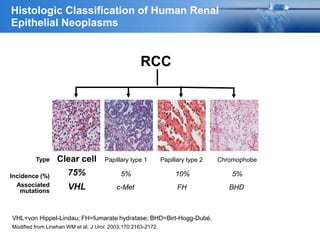
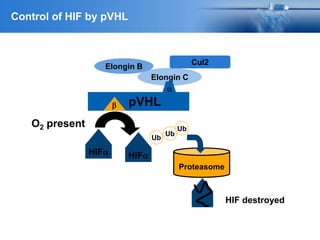
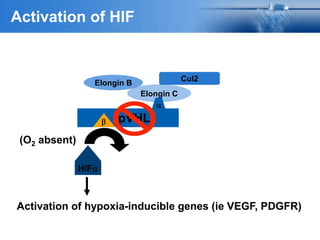
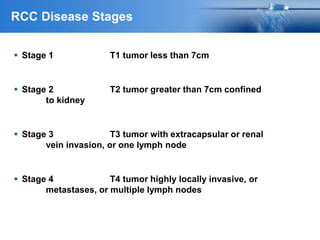
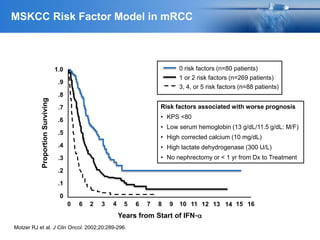
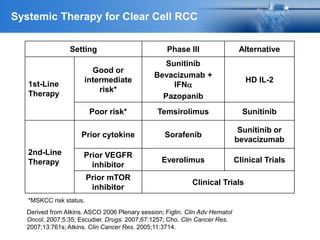
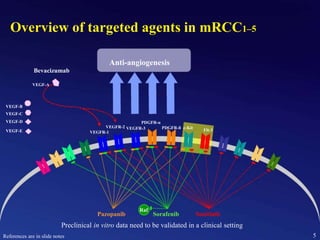
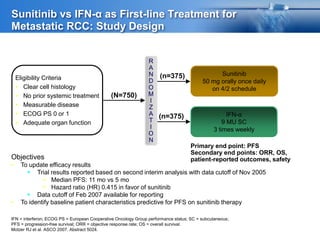
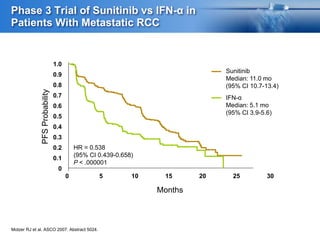
Este documento presenta información sobre el cáncer de próstata, incluyendo su epidemiología, factores de riesgo, métodos de detección, clasificación patológica, estadificación, pronóstico y opciones de tratamiento. Discute los beneficios y riesgos del tamizaje de PSA, así como las recomendaciones de varias organizaciones. También cubre temas como la biología molecular del cáncer de próstata, técnicas de diagnóstico y valoración pronóstica.