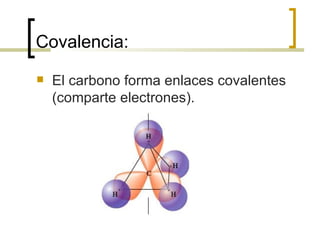
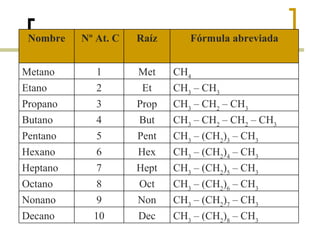
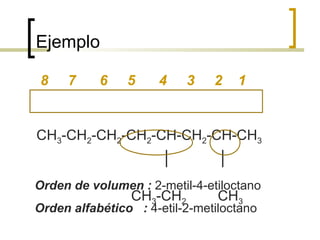
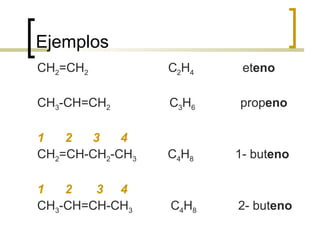
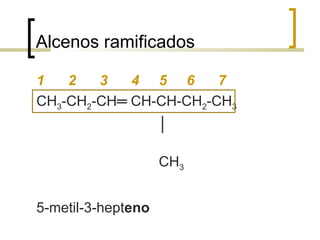
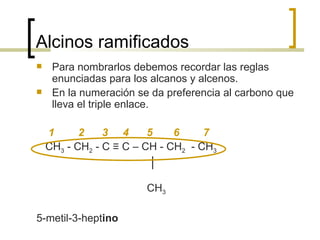
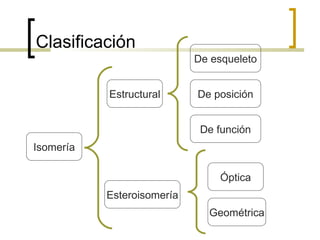
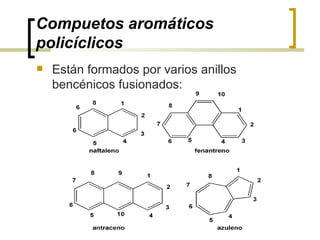
Este documento trata sobre hidrocarburos orgánicos. Define la química orgánica y describe las propiedades del carbono, incluyendo su estructura electrónica, hibridación y tipos de enlaces. Explica los diferentes tipos de hidrocarburos como alcanos, alcenos, alcinos y cicloalcanos. También cubre la nomenclatura IUPAC y los conceptos de isomería.