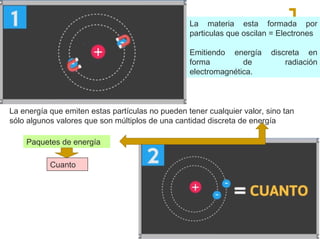
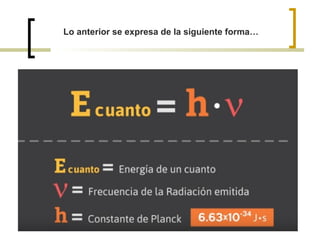
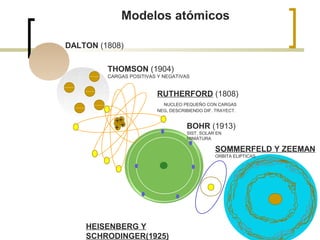
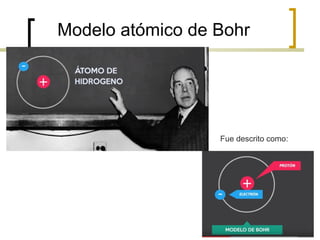
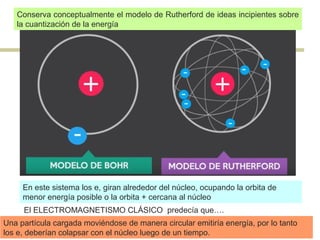
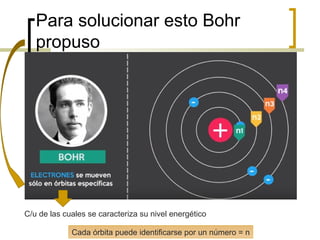
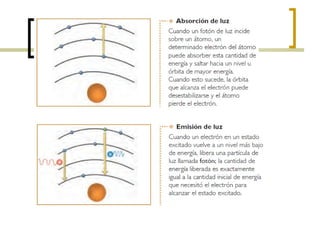
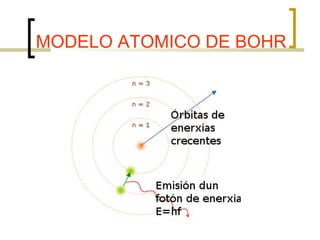
El documento describe el modelo atómico de Niels Bohr de 1913. Bohr propuso que los electrones solo pueden orbitar el núcleo en órbitas discretas o niveles de energía. Cuando un electrón cambia de un nivel energético más alto a uno más bajo, emite un paquete de energía en forma de radiación electromagnética de una longitud de onda específica. Esto resolvió los problemas con el modelo atómico anterior de Rutherford, que predecía que los átomos serían inestables.