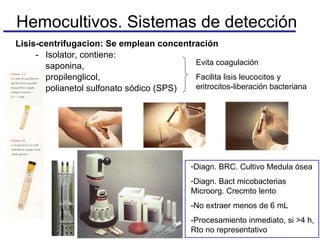
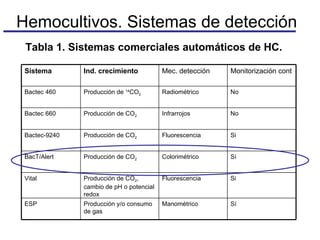
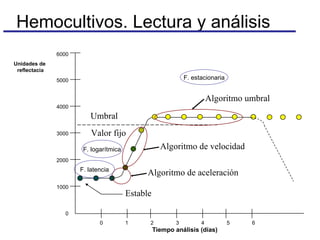
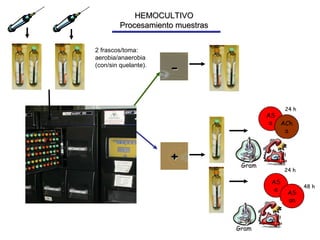
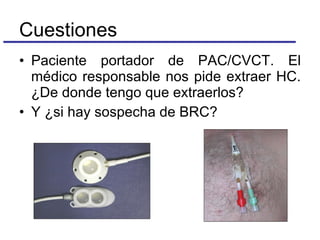
El documento detalla procedimientos y recomendaciones para la extracción y cultivo de sangre en hemocultivos, enfatizando la importancia de la toma adecuada de muestras y la reducción de contaminaciones. Se discuten medios de cultivo, sistemas de detección, y se ofrecen pautas específicas sobre condiciones y técnicas para maximizar la positividad y la precisión en el diagnóstico de bacteriemias. Además, se abordan preguntas frecuentes y consideraciones sobre la manipulación de equipos y muestras en diferentes situaciones clínicas.