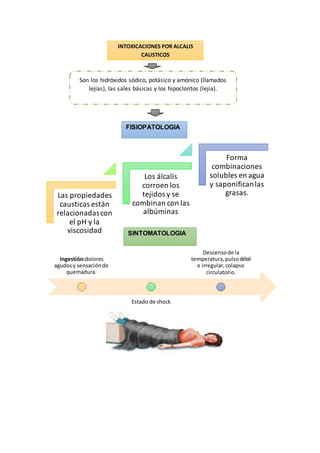
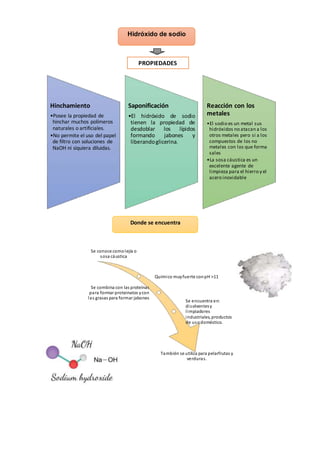
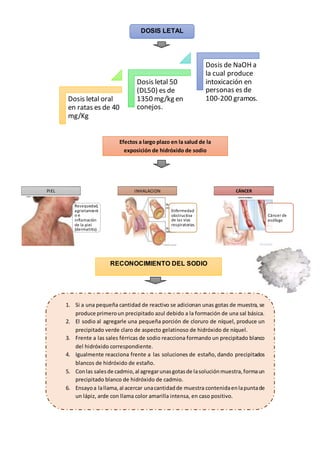
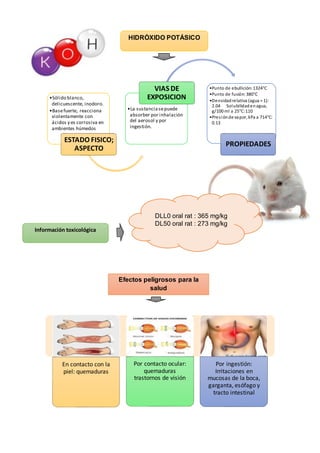
Este documento describe las propiedades y efectos de la intoxicación por hidróxido de sodio y hidróxido de potasio. El hidróxido de sodio, también conocido como sosa cáustica, es muy corrosivo con un pH superior a 11. Al entrar en contacto con la piel o los ojos puede causar quemaduras graves. La ingestión puede causar dolor agudo, shock y daño al esófago. El documento también proporciona métodos para reconocer el sodio y el potasio mediante reacciones químicas características