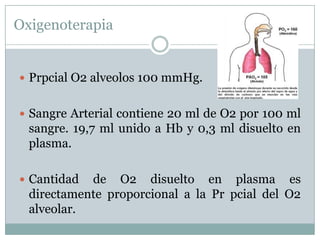
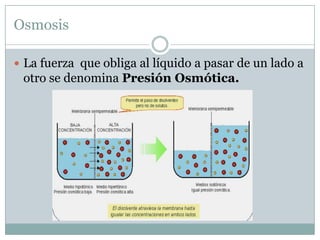
Este documento trata sobre la disolución de gases, la difusión y la osmosis. Explica que los gases se disuelven en líquidos al hacer contacto, y que la cantidad disuelta depende de la presión y la temperatura. También describe las leyes de Henry y Fick que rigen estos procesos. Finalmente, define la osmosis como la migración de moléculas a través de membranas semipermeables, impulsada por la diferencia de concentración entre los lados de la membrana.






![Coeficiente de Partición
Cuando 2 o mas fluidos no miscibles se ponen en
contacto, se denominan fases.
Es la relación entre las [] de un gas en dos fases en
equilibrio, es decir hay igual presión parcial del gas
en los dos compartimientos de un sistema y no hay
paso de un gas en ningún sentido.](https://image.slidesharecdn.com/disoluciondegases-120103184813-phpapp02/85/Disolucion-de-gases-9-320.jpg)