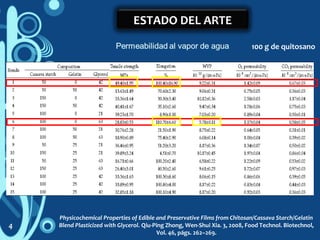
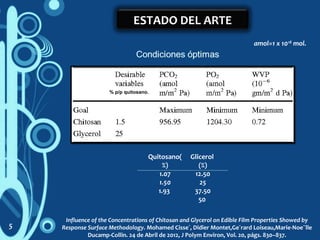
1) El documento describe un estudio sobre la caracterización de biopelículas a base de quitosano y pectina utilizando diferentes técnicas analíticas. 2) Se investigarán las propiedades de las biopelículas variando las concentraciones de quitosano, pectina, solventes y glicerol utilizando un modelo estadístico. 3) El objetivo es optimizar las propiedades de permeabilidad al vapor de agua, permeabilidad al oxígeno y resistencia a la tensión de las biopelículas.













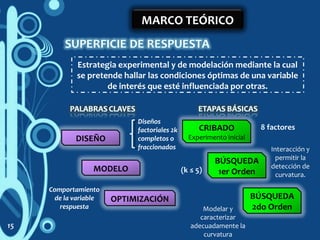

![METODOLOGÍA
Medición del
pH
Método de
casting
Medición del
espesor
Potenciómetro
Conductronic
PC18 a
temperatura
ambiente
Digimatic
IP65
MITUTOYO
10
17
50 ml, 60 °C
5 h
< 1,0 mm
[0,04 in] ASTM
D 638 – 03](https://image.slidesharecdn.com/protocoloary-140602232404-phpapp01/85/Ejemplo-PROTOCOLO-20-320.jpg)




![REFERENCIAS
1. ¿Biopelículas comestibles? Garciglia, Rafael Salgado. 6, 2012, Saber más. Universidad Michoacana
de San Nicolás de Hidalgo, págs. 4-5.
2. PELÍCULAS Y CUBIERTAS DE QUITOSANA EN LA CONSERVACIÓN DE VEGETALES. García,
Mario A. 1, 2008, Ciencia y Tecnología de Alimentos, Vol. 18, págs. 71-76.
3. Physicochemical Properties of Edible and Preservative Films from Chitosan/Cassava Starch/Gelatin
Blend Plasticized with Glycerol. Qiu-Ping Zhong, Wen-Shui Xia. 3, 2008, Food Technol. Biotechnol, Vol.
46, págs. 262–269.
4. Moléculas pécticas: extracción y su potencial aplicación como empaque. Daniela Sánchez Aldana-
Villarruel, Cristóbal Noé Aguilar-González, Juan Carlos Contreras-Esquivel, Gpe. Virginia Nevárez-
Moorillón. 2, 20 de Junio de 2011, Tecnociencia, Vol. 5, págs. 76-82.
5. Characteristics of different molecular weight chitosan films affected by the type of organic solvents. S.Y.
PARK, K.S. MARSH, AND J.W. RHIM. 2002, Food Engineering and Physical Properties.
6. Development of an edible coating based on chitosan-glycerol to delay ‘Berangan’ banana (Musa
sapientum cv. Berangan) ripening process. Jafarizadeh Malmiri H., Osman A., Tan C.P.,Abdul Rahman
R. 3, 2011, International Food Research Journal, Vol. 18, págs. 989-997.
7. Influence of the Concentrations of Chitosan and Glycerol on Edible Film Properties Showed by
Response Surface Methodology. Mohamed Cisse´, Didier Montet,Ge´rard Loiseau,Marie-Noe¨lle
Ducamp-Collin. 24 de Abril de 2012, J Polym Environ, Vol. 20, págs. 830–837.
8. Envases biodegradables: una necesidad de compromiso. Pardo, L., Menéndez, J. y Giraudo, M. 292,
Argentina : s.n., 2011, La Alimentación Latinoamericana, págs. 42-44.
9. Elaboración y caracterización de películas biodegradables a base de nanobiopartículas (mucilago y
pectina) de nopal verdura (Opuntia ficus-indica). J.C. Guevara-Arauza, J.D. Pérez-Martinez, J.deJ.
Órnelas-Paz. 2011, Nanomex'11 Encuentro Internacional e Interdisciplinario en Nanociencia y
Nanotecnología.
10. Chitosan/Pectin Laminated Films. Peter D .Hoagland, Nicholas Parris. 7, 1996, Journal of Agricultural
and Food Chemistry, Vol. 44, págs. 1915-1919.
11. ASTM E96–00, Standard Test Methods for Water Vapor Transmission of Materials. [Annual Book of
ASTM Standards].
12. García, Patricia Guillermina Mendoza. Desarrollo de películas activas para el envasado de
alimentos. Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional . 2009. TESIS.21](https://image.slidesharecdn.com/protocoloary-140602232404-phpapp01/85/Ejemplo-PROTOCOLO-25-320.jpg)
![13. Quiñones, Olga Miriam Rutiaga. Elaboración de películas plásticas flexibles a partir de polímeros
naturales como una alternativa de empaque y la evaluación de sus propiedades. Facultad de Ciencias
Biológicas. División de Estudios de Posgrado, Universidad Autónoma de Nuevo León. 2002.
14. Industrialización de los crustáceos para la obtención de Quitosano en ungüento con efecto cicatrizante.
Teonila García Zapata, Johana Melissa Roca Ortega. 2, Octubre de 2008, Revista de la Facultad de
Ingeniería Industrial, Vol. 11, págs. 24-32.
15. Pseidy Luz Mamani Crispín, Roberto Ruiz Caro, Mª Dolores Veiga. Pectina: Usos farmaceúticos y
aplicaciones terapeúticas. Departamento de farmacia y tecnología farmaceútica., Universidad Complutense
de Madrid. 2011. REVIEW.
16. Cristian Albacete, Amparo Chiralta, Chelo González-Martíneza. Efecto de la humedad y del glicerol
en las transiciones de fase de biopolímeros: Proteína de guisante y quitosano. Departamento de
Tecnología de Alimentos, Instituto Universitario de Ingeniería de Alimentos para el Desarrollo, Universidad
Politécnica de Valencia. 2013.
17. Torres, Raiza, y otros. Optimización en Modelos de Superficies de Respuesta. Facultad de
Agronomía, Universidad Central de Venezuela. 2003. págs. 69-83, REVIEW.
18. Melo, Susana Anguiano. Caracterización de películas de quitosano de bajo peso molecular obtenidas
mediante diferentes sistemas de ácidos orgánicos como solventes. Instituto Tecnológico de Zacatepec.
2010. TESIS.
19. An Outline of Standard ASTM E96 for Cup Method Water Vapor Permeability Testing. [Labthink
Instruments CO., ].
20. CARACTERIZACIÓN DE PELÍCULAS A BASE DE CASEINATO, CON FUNCIÓN ANTIMICROBIANA
PROVENIENTE DE CALDOS DE FERMENTACIÓN DE Streptococcus sp. AISLADO DEL POZOL. B.
Mendoza-Mendoza, A.I. Rodríguez-Hernández, G. Díaz-Ruiz, R. Montiel-Duarte. 2013, Nousitz : Revista
de Investigación Científica y Tecnológica, Vol. 54, págs. 1-6.
21. ASTM D882–02. Standard Test Method for Tensile Properties of Thin Plastic Sheeting. [Annual Book of
ASTM Standards].
22. Estudio del tratamiento térmico sobre las propiedades de películas híbridas de grenetina-nanoarcilla. E.
M. Subdíaz-Guadarrama, J. C. Ochoa-Jaimes, A. Stefanoni-Altamirano, A. Perfecto-Peralta, J. R.
Rendón-Villalobos, R. Salgado-Delgado, E. García-Hernández. 2013, Nousitz : Revista de Investigación
Científica y Tecnológica, Vol. 54, págs. 45-50.
23. Estudio de las propiedades de biopelículas a base de celulosa obtenida a partir del bagazo de caña. N.
P. Delgado Hernández, E. García Hernández, J. R. Rendón Villalobos, R. Salgado Delgado, Z. Vargas
Galarza y G. Arámbula Villa. 2013, Nousitz : Revista de Investigación Científica y Tecnológica, Vol. 54,
págs. 36-44.
24. Development of model for barrier and optical properties of tapioca starch based edible films. J. Prakash
Marana, V. Sivakumarb, R. Sridharc, K. Thirugnanasambandhamd. s.l. : ELSEVIER, 2012,
Carbohydrate Polymers, Vol. 92, págs. 1335– 1347.
22](https://image.slidesharecdn.com/protocoloary-140602232404-phpapp01/85/Ejemplo-PROTOCOLO-26-320.jpg)
