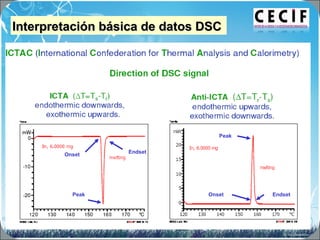
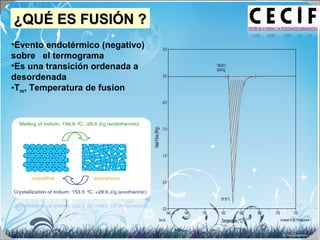
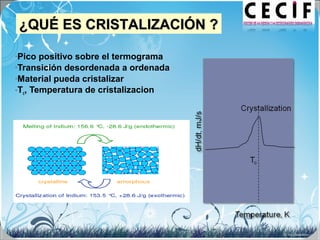
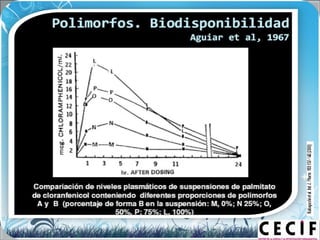
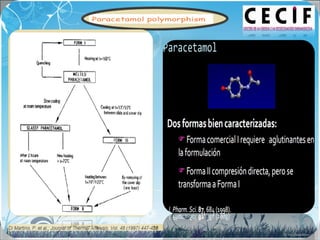
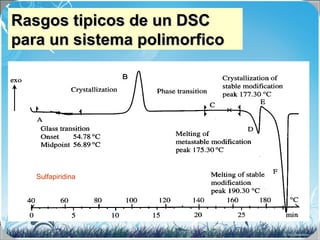
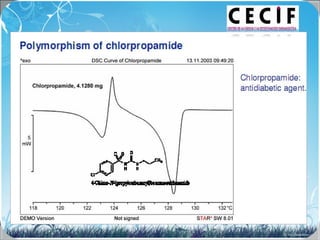
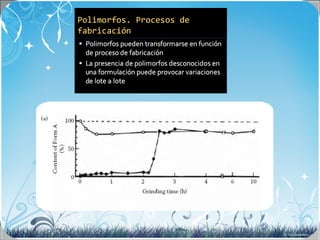
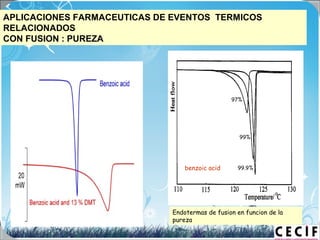
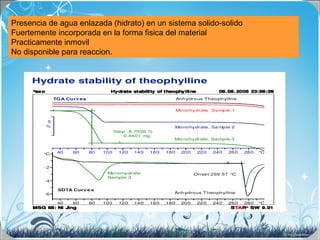
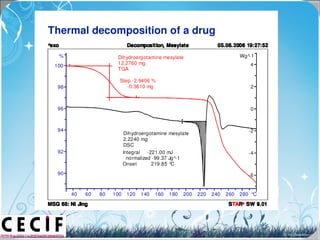
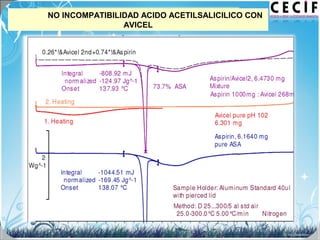
La calorimetría diferencial de barrido (DSC) es una técnica analítica térmica que mide los cambios en el flujo de calor de una muestra cuando se calienta o enfría. El DSC se puede utilizar para caracterizar transiciones de fase como la fusión, la cristalización y la transición vítrea, así como para determinar la pureza de compuestos y estudiar la compatibilidad entre principios activos y excipientes farmacéuticos.





![En general, hay tres tipos de información
que se pueden obtener a partir de la DSC:
1. La capacidad calorífica parcial absoluta
del compuesto de interés.
2. Los parámetros termodinámicos
globales (los cambios de entalpía [DH],
de entropía [DS], de energía de Gibbs
[DG] y de la capacidad calorífica [DCp])
asociados a la transición inducida por
temperatura.
3. Estados relevantes del sistema y sus
parámetros termodinámicos.](https://image.slidesharecdn.com/calorimetriadebarrido-101109105612-phpapp01/85/Calorimetria-de-barrido-7-320.jpg)