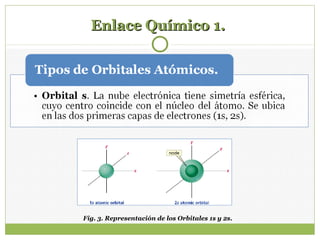
Este documento trata sobre los enlaces químicos. Explica conceptos como los números cuánticos, los orbitales atómicos y sus niveles de energía, y cómo se forman los enlaces sigma y pi a partir de los orbitales atómicos. También incluye ejemplos de la configuración electrónica de átomos como el carbono y el oxígeno, y cómo se determina la hibridación en moléculas como el metano.