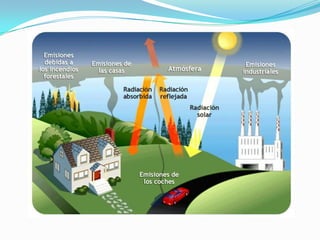
El documento trata sobre el oxígeno, un gas incoloro e inodoro que constituye aproximadamente una quinta parte del aire y es esencial para la respiración. Se describe que el oxígeno es un elemento clave en química orgánica y biología, y es indispensable en medicina, industria y ciencia. También se mencionan los descubridores del oxígeno y usos como la generación a través de la fotosíntesis y la utilización en la respiración.